3.3: Partículas Subatómicas – Electrões, Protões e Neutrões
Identificando e Localizando as Partículas Subatómicas
Em 1897, o físico britânico J. J. Thomson (1856-1940) provou que os átomos não eram a forma mais básica de matéria. As suas experiências envolveram o uso de tubos de raios catódicos (CRT). Sob um ambiente aspirado, esses dispositivos produzem raios invisíveis que se originam de um eletrodo negativo (cátodo) e continuam para um eletrodo positivo (ânodo). Nestas experiências, Thomson demonstrou que os raios catódicos podiam ser desviados, ou dobrados, por campos magnéticos ou elétricos, o que indicava que os raios catódicos consistem em partículas carregadas. Mais importante, ao medir a extensão da deflexão dos raios catódicos em campos magnéticos ou elétricos de várias forças, Thomson foi capaz de calcular a relação massa/carga das partículas. Como as cargas se repelem umas às outras e as cargas opostas se atraem, Thomson concluiu que as partículas tinham uma carga líquida negativa; essas partículas são agora chamadas de elétrons. Mais relevante para o campo da química, Thomson descobriu que a relação massa/carga dos raios catódicos é independente da natureza dos eletrodos metálicos ou do gás, o que sugeriu que os elétrons eram componentes fundamentais de todos os átomos.
> Nos anos 1910, experiências com raios X levaram a esta conclusão útil: a magnitude da carga positiva no núcleo de cada átomo de um elemento em particular é a mesma. Em outras palavras, todos os átomos de um mesmo elemento têm o mesmo número de prótons. Além disso, elementos diferentes têm um número diferente de prótons em seus núcleos, portanto, o número de prótons no núcleo de um átomo é característico de um elemento em particular. Esta descoberta foi tão importante para a nossa compreensão dos átomos que o número de prótons no núcleo de um átomo é chamado de número atómico. Estas experiências foram realizadas por Ernest Rutherford. Ele é creditado com a definição de uma localização central do átomo que agora foi chamado de núcleo.
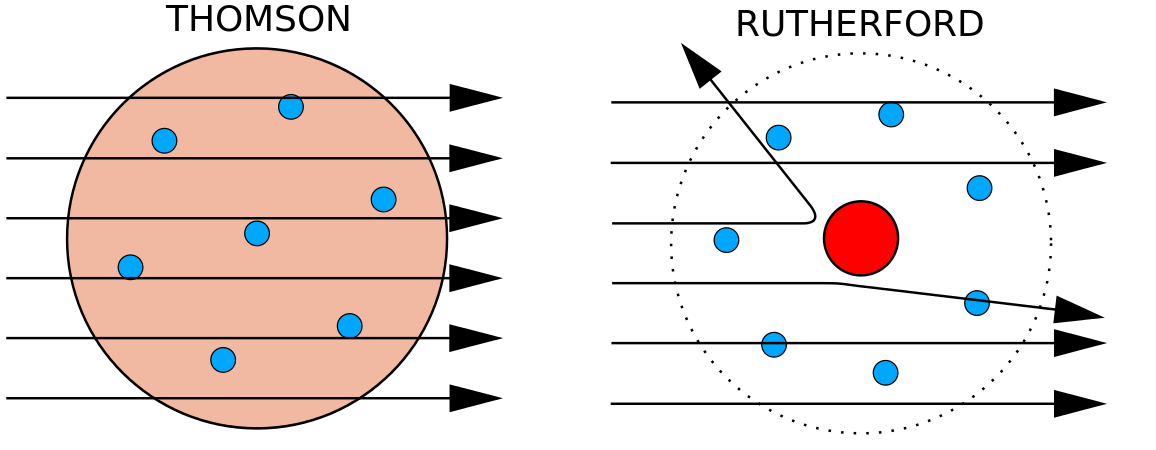
Rutherford estava ciente de que os prótons estavam dentro desta região. Um dos colegas de Ernest Rutherford, James Chadwick, realizou e estudou reações radioativas de berílio. Ao atingir um núcleo de berílio com partículas alfa, uma partícula de nêutrons foi emitida. Em 1932, James Chadwick anunciou a existência de uma terceira partícula subatômica, o nêutron. Esta partícula tem uma massa de 1 unidade de massa atómica, mas não tem qualquer carga. Após esta descoberta, a ciência e tecnologia nuclear começou imediatamente.
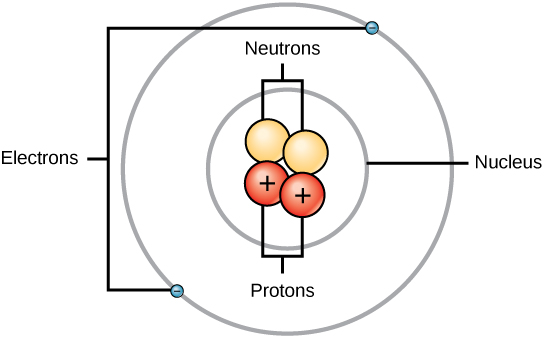
Massa para as três partículas subatômicas podem ser expressas em amu (unidades de massa atômica) ou gramas. Para simplificar, vamos usar a unidade amu para as três subatômicas. Tanto os neutrões como os prótons são atribuídos como tendo massas de 1 amu cada um. Em contraste, o elétron tem uma massa negligenciável de 0,0005 amu. A massa desta subatômica não é representada na massa decimal que é exibida na tabela periódica. Apenas prótons e nêutrons contribuem para o valor da massa de um átomo.
pt:User:Materialscientist)
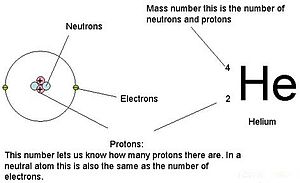
Para átomos (espécies neutras), o número de elétrons é equivalente ao número de prótons. Como resultado, todos os átomos têm uma carga total de zero. Para discussão dos íons (átomos que ganham ou perdem elétrons), olhe para a última parte deste capítulo. Os átomos que diferem em valores de neutrões e massa da tabela são chamados de isótopos. Estas espécies particulares podem ser vistas na secção seguinte do texto.
| Partícula Subatómica | Símbolo | Carga Relativa | Localização | Massa de Amu |
|---|---|---|---|---|
| Protão | p | +1 | inside the nucleus | 1 |
| Neutron | n | 0 | inside the nucleus | 1 |
| Electron | e- | -1 | fora do núcleo | 0.0005 (~0) |
Exemplo \(\PageIndex{1})
O que é verdade?
- O núcleo contém prótons e elétrons.
- A massa de um electrão está incluída na massa do átomo
- Para um átomo, o número de prótons = número de electrões.
Solução
- Falso, o núcleo contém os prótons e os neutrões. Os elétrons estão fora do núcleo.
- Falso, os elétrons não contribuem para o número de massa de um átomo.
- Verdadeiro, todos os átomos são neutros e devem ter o mesmo número de prótons que os elétrons.




