CHEM 101 – Electrólitos
TÓPICOS QUÍMICOS GERAIS
Electrólitos
Dissociação de compostos iónicos na água resulta na formação de espécies iónicas aquosas móveis. Electrólitos fortes e fracos.
Electrolitos (acompanhamento musical deste tópico) são substâncias que criam espécies iónicas em solução aquosa. A existência de portadores de carga em solução pode ser demonstrada por meio de uma simples experiência. A condutividade dos meios aquosos pode ser observada através da utilização de um par de eléctrodos, ligados a uma fonte de tensão, que estão imersos na solução. A corrente que a solução conduz pode então ser facilmente medida e uma lâmpada pode ser usada como um indicador visual da condutividade de uma solução.
Quando esta experiência é realizada com água pura, a lâmpada não brilha de todo. A água em si não conduz electricidade facilmente; é um exemplo de uma substância molecular que não é um electrólito. Isto é verdade para muitas outras substâncias moleculares. Por exemplo, o açúcar de mesa (sacarose, C12H22O11) – é bastante solúvel em água, mas uma solução de açúcar aparentemente não conduz electricidade melhor do que apenas água. Por outro lado, quando realizamos a experiência com um composto iônico livremente solúvel como o cloreto de sódio, a lâmpada incandescente brilha intensamente.
Deixe-nos representar o que pensamos estar a acontecer com estes casos contrastantes de dissolução de um composto iónico e molecular escrevendo as seguintes equações químicas:
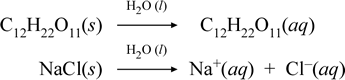
A primeira equação acima representa a dissolução de um não electrólito, o composto molecular sacarose. A segunda equação representa a dissolução de um composto iônico, o cloreto de sódio. A principal distinção entre as duas equações químicas neste caso é a formação na última de espécies iônicas aquosas como produtos. Os íons são livres para se difundirem individualmente em uma mistura homogênea, e quando uma tensão é aplicada, os íons se moverão de acordo com a diferença de energia potencial elétrica entre os eletrodos, transportando assim corrente elétrica. Note que a água não é mostrada no lado reativo destas equações, mas sim acima da seta, indicando que a água determina o ambiente em que ocorre o processo de dissolução. O estado superstoíquico da água neste simbolismo pode ser lido como um processo de dissolução que ocorre com a água como solvente. Não escreveremos a água como um reagente na formação de uma solução aquosa por um simples processo de dissolução. Há muitos casos em que uma substância reage com água à medida que se mistura com água e se dissolve na água. Esta reacção de um soluto em solução aquosa dá origem a produtos quimicamente distintos. Nesses casos a água pode ser mostrada explicitamente na equação química como uma espécie reagente.
Electrólitos fortes e fracos
Acontece que quando um composto iónico solúvel como o cloreto de sódio sofre dissolução em água para formar uma solução aquosa constituída por iões solvados, a seta para a direita utilizada na equação química é justificada na medida em que (desde que o limite de solubilidade não tenha sido atingido) o cloreto de sódio sólido adicionado à água solvente se dissocia completamente. Em outras palavras, efetivamente há 100% de conversão de NaCl(s) para Na+(aq) e Cl-(aq). Como resultado, em nosso experimento de condutividade, uma solução de cloreto de sódio é altamente condutiva devido à abundância de íons, e a lâmpada incandescente brilha intensamente. Neste caso, dizemos que o cloreto de sódio é um eletrólito forte.
Em contraste, consideremos a substância molecular ácido acético, HC2H3O2. Quando o ácido acético é dissolvido em água, forma uma espécie molecular não dissociada, solvada, simbolizada como HC2H3O2(aq), semelhante ao caso com a sacarose acima. Entretanto, quando realizamos nosso teste de condutividade com uma solução de ácido acético, verificamos que a lâmpada incandescente brilha, embora de forma bastante fraca em relação ao brilho observado para a solução de cloreto de sódio. Neste caso, deve haver pelo menos a formação parcial de íons do ácido acético na água. Uma equação química representando este processo deve mostrar a produção de iões. Uma proposta razoável para tal equação seria:
![]()
Duas coisas são importantes de se notar aqui. Primeiro, este é um caso em que incluímos a água como um reagente. As duas substâncias moleculares, água e ácido acético, reagem para formar os íons poliatômicos hydronium e acetato. A equação que representa isto é uma equação iónica. A segunda característica que merece mais discussão é a substituição da seta para a direita pelo símbolo das setas de barra dupla, significando um equilíbrio químico e, neste caso, a condição de equilíbrio para a reação favorece os reagentes, significando que em uma solução aquosa de ácido acético, a maior parte do ácido acético permanece como moléculas de ácido acético, com apenas uma pequena proporção, a qualquer momento, tendo cedido H+ à água para formar os íons. O pequeno número de íons produzidos explica porque a solução de ácido acético não conduz eletricidade assim como a solução de cloreto de sódio, resultando apenas em uma fraca iluminação da lâmpada do nosso detector de condutividade. Portanto, fazemos uma distinção entre eletrólitos fortes, como o cloreto de sódio, e o ácido acético, que é um exemplo de um eletrólito fraco.
Como o nome ácido acético sugere, esta substância também é um ácido, assim como um eletrólito fraco. Consequentemente, classificamos o ácido acético como um ácido fraco. Nossa primeira (e menos geral) definição de um ácido é uma substância que cria íon hidrônio na água, que é exatamente o que nossa equação iônica acima mostra, tendo em mente que um ácido fraco cria quantidades relativamente pequenas de íon hidrônio.
Os químicos gostam muito de abreviações, e uma abreviação importante para o íon hidrónico é H+(aq), e isto é comumente usado. Isto é mostrado na versão abreviada da equação acima, que é mostrada logo abaixo. Para ser claro, o H+ em si seria apenas um próton isolado (para 1H); assim também é importante notar que não existe tal espécie em solução aquosa.
Outras vezes, as setas foram feitas de comprimento desigual para indicar o equilíbrio favorecido pelo reator, no qual há muito menos íons do que moléculas de ácido acético.
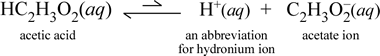
Ao representar o hidronium como H+(aq), a equação iônica para o ácido acético na água é formalmente equilibrada sem incluir uma molécula de água como um reagente, o que está implícito na equação acima.
Ammonia: Um exemplo de um eletrólito fraco que é uma base fraca
Ácido acético como acabamos de ver é um composto molecular que é ácido fraco e eletrólito. A amônia, NH3, outro composto molecular simples, também reage em pequena escala com a água, formando íons de amônio e hidróxido. Nossa primeira e menos geral definição de base é uma substância que cria íons hidróxidos na água. Assim, a amônia é uma base fraca, e como o ácido acético, não conduz eletricidade quase tão bem quanto o sal aquoso. Portanto, o amoníaco também é um eletrólito fraco.
![]()
O simbolismo da nossa equação química indica novamente um equilíbrio favorecido por reactantes para o electrólito fraco.
Extensões e ligações
Uma abordagem mais quantitativa ao equilíbrio utiliza ácidos fracos e bases fracas como exemplos importantes.




