Chemistry
A formação de uma solução é um exemplo de um processo espontâneo, um processo que ocorre sob condições especificadas sem a necessidade de energia de alguma fonte externa. Às vezes mexemos uma mistura para acelerar o processo de dissolução, mas isso não é necessário; uma solução homogênea se formaria se esperássemos o tempo suficiente. O tema da espontaneidade é criticamente importante para o estudo da termodinâmica química e é tratado com mais profundidade em um capítulo posterior deste texto. Para efeitos da discussão deste capítulo, bastará considerar dois critérios que favorecem, mas não garantem, a formação espontânea de uma solução:
- uma diminuição da energia interna do sistema (uma mudança exotérmica, como discutido no capítulo anterior sobre termoquímica)
- um aumento da desordem no sistema (que indica um aumento da entropia do sistema, como você aprenderá no capítulo posterior sobre termodinâmica)
No processo de dissolução, uma mudança de energia interna ocorre frequentemente, mas nem sempre, à medida que o calor é absorvido ou evolui. Um aumento na desordem sempre resulta quando uma solução se forma.
Quando as forças de atração intermoleculares entre espécies de soluto e solvente em uma solução não são diferentes daquelas presentes nos componentes separados, a solução é formada sem a mudança de energia que a acompanha. Tal solução é chamada de solução ideal. Uma mistura de gases ideais (ou gases como hélio e argônio, que se aproximam do comportamento ideal) é um exemplo de solução ideal, uma vez que as entidades que compõem esses gases não experimentam atrações intermoleculares significativas.
Quando recipientes de hélio e argônio estão conectados, os gases se misturam espontaneamente devido à difusão e formam uma solução (Figura 2). A formação desta solução envolve claramente um aumento da desordem, pois os átomos de hélio e argônio ocupam um volume duas vezes maior do que aquele que cada um ocupava antes da mistura.
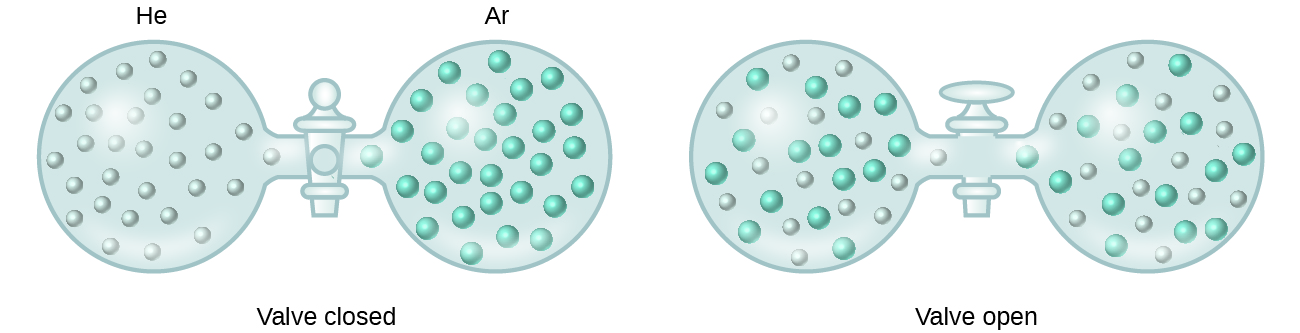
Soluções de hélio e argônio também podem se formar quando líquidos estruturalmente semelhantes são misturados. Por exemplo, misturas dos álcoois metanol (CH3OH) e etanol (C2H5OH) formam soluções ideais, assim como misturas dos hidrocarbonetos pentano, C5H12, e hexano, C6H14. A colocação de metanol e etanol, ou pentano e hexano, nos bulbos mostrados na Figura 2 resultará na mesma difusão e subseqüente mistura desses líquidos que é observada para os gases He e Ar (embora a um ritmo muito mais lento), produzindo soluções sem alteração significativa de energia. Ao contrário de uma mistura de gases, porém, os componentes dessas soluções líquido-líquido experimentam, de fato, forças atrativas intermoleculares. Mas como as moléculas das duas substâncias misturadas são estruturalmente muito semelhantes, as forças de atracção intermoleculares entre moléculas semelhantes e diferentes são essencialmente as mesmas, e o processo de dissolução, portanto, não implica qualquer aumento ou diminuição apreciável de energia. Estes exemplos ilustram como a difusão por si só pode fornecer a força motriz necessária para causar a formação espontânea de uma solução. Em alguns casos, entretanto, a relativa magnitude das forças de atração intermoleculares entre espécies de soluto e solvente pode impedir a dissolução.
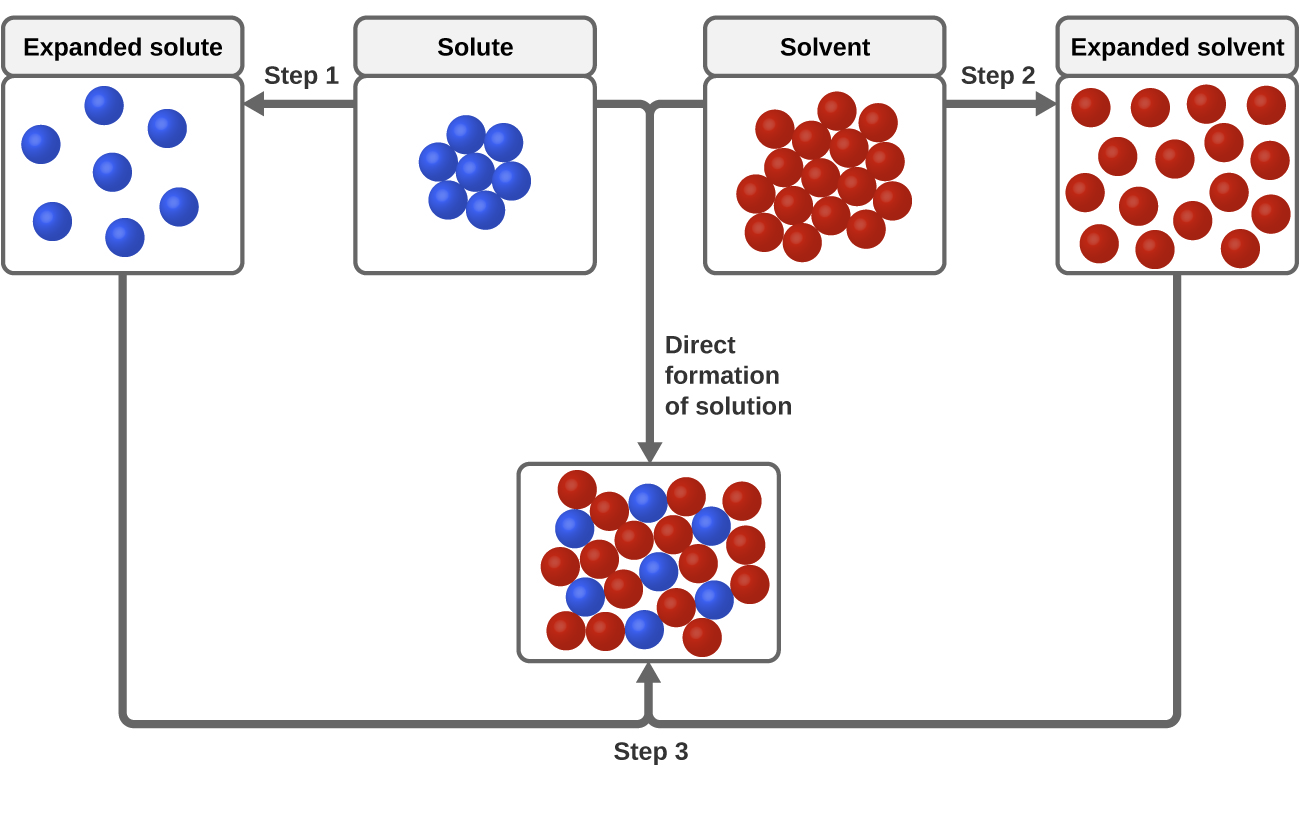
Três tipos de forças de atração intermoleculares são relevantes para o processo de dissolução: soluto-soluto, solvente-solvente e soluto-solvente. Como ilustrado na Figura 3, a formação de uma solução pode ser vista como um processo gradual no qual a energia é consumida para superar as atrações soluto-soluto e solvente-solvente (processos endotérmicos) e liberada quando as atrações soluto-solvente são estabelecidas (um processo exotérmico referido como solvente-solvente). As magnitudes relativas das mudanças de energia associadas a esses processos por etapas determinam se o processo de dissolução em geral irá liberar ou absorver energia. Em alguns casos, as soluções não se formam porque a energia necessária para separar as espécies de soluto e solvente é muito maior do que a energia liberada pela solvência.
Por exemplo, óleos de cozinha e água não se misturarão de forma apreciável para produzir soluções (Figura 4). A ligação de hidrogênio é a força de atração intermolecular dominante presente na água líquida; as moléculas não polares de hidrocarbonetos dos óleos de cozinha não são capazes de se ligar ao hidrogênio, ao invés de serem mantidas juntas por forças de dispersão. A formação de uma solução óleo-água exigiria a superação da muito forte ligação de hidrogênio na água, bem como as forças de dispersão significativamente fortes entre as moléculas de óleo relativamente grandes. E como as moléculas polares de água e as moléculas não polares de óleo não experimentariam uma atração intermolecular muito forte, muito pouca energia seria liberada pela solvatação.

Por outro lado, uma mistura de etanol e água se misturará em qualquer proporção para produzir uma solução. Neste caso, ambas as substâncias são capazes de se ligar ao hidrogênio, e assim o processo de solvação é suficientemente exotérmico para compensar as separações endotérmicas de moléculas de soluto e solvente.
Como observado no início deste módulo, a formação espontânea de solução é favorecida, mas não garantida, por processos de dissolução exotérmica. Enquanto muitos compostos solúveis dissolvem-se, de facto, com a libertação de calor, alguns dissolvem-se endotermaticamente. O nitrato de amônio (NH4NO3) é um desses exemplos e é usado para fazer embalagens frias instantâneas para o tratamento de lesões como a que está ilustrado na Figura 5. Um saco plástico de paredes finas de água é selado dentro de um saco maior com NH4NO3 sólido. Quando o saco menor é quebrado, forma-se uma solução de NH4NO3, absorvendo o calor do ambiente (a área ferida à qual a embalagem é aplicada) e fornecendo uma compressa fria que diminui o inchaço. Dissoluções endotérmicas como esta requerem uma maior entrada de energia para separar a espécie de soluto do que é recuperado quando os solutos são solvidos, mas são espontâneas devido ao aumento da desordem que acompanha a formação da solução.

 >
>
Veja este breve vídeo ilustrando processos de dissolução endotérmica e exotérmica.
Conceitos Chave e Resumo
Forma-se uma solução quando duas ou mais substâncias se combinam fisicamente para produzir uma mistura homogênea a nível molecular. O solvente é o componente mais concentrado e determina o estado físico da solução. Os solutos são os outros componentes tipicamente presentes em concentrações inferiores às do solvente. As soluções podem formar endotérmica ou exotermicamente, dependendo da magnitude relativa das forças de atracção intermoleculares do soluto e do solvente. Soluções ideais se formam sem mudança significativa de energia.
Chemistry End of Chapter Exercises
- How do solutions different from compounds? De outras misturas?
- Qual das principais características das soluções podemos ver nas soluções de K2Cr2O7 mostradas na Figura 1?
- Quando KNO3 é dissolvido em água, a solução resultante é significativamente mais fria do que a água era originalmente.
(a) A dissolução de KNO3 é um processo endotérmico ou exotérmico?
(b) Que conclusões você pode tirar sobre as atrações intermoleculares envolvidas no processo?
(c) A solução resultante é uma solução ideal?
- Dê um exemplo de cada um dos seguintes tipos de soluções:
(a) um gás em um líquido
(b) um gás em um gás
(c) um sólido em um sólido
- Indique os tipos mais importantes de atrações intermoleculares em cada uma das seguintes soluções:
(a) A solução da Figura 1.
(b) NO(l) em CO(l)
(c) Cl2(g) em Br2(l)
(d) HCl(aq) em benzeno C6H6(l)
(e) Metanol CH3OH(l) em H2O(l)
- Prever se cada uma das seguintes substâncias seria mais solúvel em água (solvente polar) ou em um hidrocarboneto como o heptano (C7H16), solvente não polar):
(a) óleo vegetal (não-polar)
(b) álcool isopropílico (polar)
(c) brometo de potássio (iónico)
- O calor é libertado quando algumas soluções se formam; o calor é absorvido quando outras soluções se formam. Fornecer uma explicação molecular para a diferença entre estes dois tipos de processos espontâneos.
- Soluções de hidrogênio no paládio podem ser formadas pela exposição do metal Pd ao gás H2. A concentração de hidrogênio no paládio depende da pressão do gás H2 aplicado, mas de uma forma mais complexa do que pode ser descrita pela lei de Henry. Sob certas condições, 0,94 g de gás hidrogênio é dissolvido em 215 g de paládio metálico.
(a) Determinar a molaridade desta solução (densidade da solução = 1,8 g/cm3).
(b) Determine a molaridade desta solução (densidade da solução = 1,8 g/cm3).
(c) Determine a percentagem em massa de átomos de hidrogénio nesta solução (densidade da solução = 1,8 g/cm3).




