Definição da Função da Onda
Particulas fundamentais, como elétrons, podem ser descritas como partículas ou ondas.

A função de onda Ψ é uma expressão matemática.Ela traz informação crucial sobre o elétron ao qual está associada:da função de onda obtemos a energia do elétron, momento angular e orientação orbital na forma dos números quânticos n, l e ml.
A função de onda pode ter um sinal positivo ou negativo.O sinal é importante nos cálculos.Também é importante quando as funções de onda de dois ou mais átomos se combinam para formar uma molécula.
Em 1926, Erwin Schrödinger deduziu a função de onda para o mais simples de todos os átomos, o hidrogênio.
A equação de Schrödinger é uma equação da mecânica quântica: as funções de onda calculadas têm valores discretos e permitidos para elétrons ligados em átomos e moléculas; todos os outros valores são proibidos.
Além da importância de Ψ, seu quadrado Ψ2 também tem enorme importância na química.
Ψ2 é a densidade de probabilidade. Ela nos diz onde o elétron é mais provável de ser encontrado no espaço ao redor do núcleo.
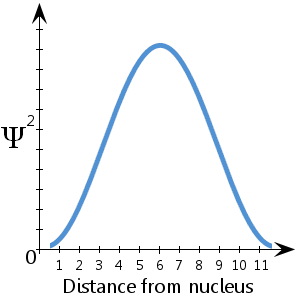
Por exemplo, no diagrama esquemático (fictício) aqui plotado, mostrando Ψ2 contra a distância do núcleo, vemos que o elétron tem maior probabilidade de ser encontrado entre cerca de 5-7 unidades do núcleo.Vemos também que há uma probabilidade cada vez menor de que o elétron esteja no núcleo ou mais do que cerca de 11½ unidades longe do núcleo.
Existe uma probabilidade de 100% de que o electrão esteja algures – por outras palavras, uma probabilidade de 1,
Ψ só pode ser calculada exactamente para átomos com um electrão, ou seja, H, He+, Li2+, Be3+, B4+, C5+, etc. Em linguagem matemática, dizemos que as soluções analíticas para Ψ são possíveis apenas para sistemas de um electrão. Os sistemas de um electrão são muitas vezes descritos como hidrogenados – o que significa “como o hidrogénio”.”
Para todos os outros átomos, íons e moléculas, nenhuma solução analítica para Ψ é possível; métodos de aproximação são necessários para calculá-lo.
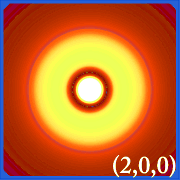
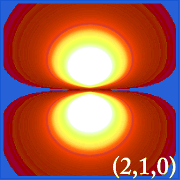
Ψ2 e Orbitais Hidrogênicos
Plotar a densidade de probabilidade de hidrogênio (i.e. Ψ2) para diferentes números quânticos permite-nos visualizar o espaço, centrado no núcleo, que os electrões ocupam. As várias distribuições de Ψ2 são orbitais de electrões do hidrogénio.O orbital que está realmente ocupado é determinado pela quantidade de energia que o elétron possui.
Exemplos de Orbitais de Hidrogénio