Frontiers in Neuroscience
Introdução
A geração de novos neurônios no hipocampo adulto, uma região do cérebro envolvida na navegação espacial e formação de memória (Buzsaki e Moser, 2013), é uma forma marcante de plasticidade que persiste ao longo da vida em várias espécies, incluindo os seres humanos (Altman e Das, 1965; Eriksson et al, 1998; Moreno-Jiménez et al., 2019). Entre as muitas condições que regulam a neurogênese hipocampal adulta, um dos processos mais confiáveis que tem sido amplamente descrito é o declínio da produção neuronal mediado pela idade, enquanto populações neuronais preexistentes permanecem constantes com o envelhecimento normal (Kuhn et al., 1996; Kempermann et al., 1998; Burke e Barnes, 2010). O envelhecimento afeta muitas funções no cérebro, incluindo a transmissão sináptica e plasticidade, que se pensa contribuir para a perda de memória (Burke e Barnes, 2006; Fan et al., 2017). Dado que o hipocampo é particularmente vulnerável a alterações relacionadas com a idade e neurodegeneração, encontrar estratégias para melhorar a plasticidade nesta estrutura torna-se relevante para prevenir ou aliviar os efeitos da senescência (Bartsch e Wulff, 2015). O exercício físico e os estímulos cognitivos melhoram a saúde cerebral e tendem a amenizar os efeitos do envelhecimento. Um dos benefícios diretos pode surgir do aumento dependente de atividade nos níveis de fator neurotrófico derivado do cérebro (FBDN), que tem demonstrado restaurar a plasticidade sináptica, melhorar a neurogenese e melhorar a aprendizagem em ratos de meia idade (Marlatt et al., 2012; Trinchero et al., 2017). O exercício também reduz a ativação de microglia, aumenta a plasticidade sináptica dependente de atividade, proliferação de células progenitoras neurais e acelera o desenvolvimento e integração de células granulares nascidas no adulto (GCs) no hipocampo envelhecido (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Estes efeitos contribuem para restaurar a plasticidade hipocampal-dependente e correlacionam-se com o comportamento adaptativo. Assim, animais envelhecidos que desempenham mal em tarefas de aprendizagem espacial e separação de padrões, melhoram seu desempenho após o exercício (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
A medida em que a neurogênese contribui para os efeitos comportamentais positivos do exercício em animais envelhecidos ainda está sob escrutínio. É possível que o aumento da taxa de neurogénese exercida pelo exercício físico contribua para a melhoria do comportamento. Mas outros mecanismos também podem estar implicados (Meshi et al., 2006). A integração acelerada de novos neurônios no giro dentado envelhecido após o exercício, que modifica a qualidade dos novos GC, também pode contribuir para a melhoria comportamental. Enquanto os neurônios nascidos em ratos de meia-idade se desenvolvem lentamente, o exercício voluntário sustentado promove o crescimento dendrítico, a formação da coluna vertebral e a integração neuronal (Trinchero et al., 2017). Efeitos similares foram observados por breves exposições ao enriquecimento ambiental (EE) (Trinchero et al., 2019). Se acumulada em múltiplos coortes neuronais, a integração neuronal acelerada desencadeada pelo exercício pode exercer influência significativa na aprendizagem e comportamento dependentes do hipocampo. Neste trabalho nós demonstramos que vários coortes de novos GC podem ser rapidamente integrados nos circuitos preexistentes de ratos que continuam a correr voluntariamente, e que estes efeitos persistem uma vez que os ratos pararam de correr.
Materiais e Métodos
Ratos e Cirurgia
C57BL/6J ratos machos foram alojados em 4-5 animais por gaiola sob condições padrão. Ratos de 8 meses (8M) foram selecionados porque, além desta idade, há um forte declínio na neurogênese hipocampal que impede o estudo de neurônios marcados (Morgenstern et al., 2008; Trinchero et al., 2017). Ratos foram anestesiados (150 μg ketamina/15 μg xilazina em 10 μl salina/g), e retrovírus foi infundido na região septal do giro dentado direito (1,5 μl a 0,15 μl/min) usando pipetas microcapilares calibradas estéreis através de cirurgia estereotaxica; coordenadas de bregma (em mm): -2 anteroposterior, -1,5 lateral, e -1,9 ventral. Nos tempos indicados, os cérebros foram fixados e os cortes foram preparados para imagens confocais (Trinchero et al., 2017). Apenas GCs do giro dentado septal foram incluídos na análise, correspondendo a cortes localizados de -0,96 a -2,30mm do bregma, de acordo com o atlas cerebral do rato (Paxinos e Franklin, 2001). Os protocolos experimentais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Fundación Instituto Leloir, de acordo com os Princípios para a Pesquisa Biomédica envolvendo animais do Council for International Organizations for Medical Sciences e as disposições do Guide for the Care and Use of Laboratory Animals.
Running
Running distances were recorded for each experiment using wireless running wheels. Nos experimentos da Figura 1, os animais foram alojados com uma roda de corrida durante 7 ou 21 dias, conforme indicado. Nesta condição, os ratos correram ∼2 km/dia. Nas Figuras 2, 3 em que os ratos correram por 1, 2 ou 3 meses, a distância monitorada foi ∼10 km/dia.
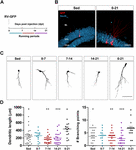
Figura 1. Períodos longos mas não curtos de corrida aceleram a maturação morfológica de novos GCs. (A) Desenho experimental. A injeção de RV-GFP foi seguida pela exposição a 1 semana de corrida voluntária nas janelas indicadas ou para todo o experimento (0-21 dpi). (B) Imagens representativas de GCs de 21 dpi expressando GFP (vermelho) tiradas de grupos sedentários e 0-21 correndo. NeuN (azul) etiqueta a camada de célula granular (GCL) (ML, camada molecular). Barra de escalas, 50 μm. (C) Imagens confocais representativas de GFP-GCs de 21 dpi para os diferentes grupos. Barra de escalas, 50 μm. (D) Complexidade dendrítica (comprimento e pontos de ramificação) para as diferentes janelas em funcionamento. ∗, ∗∗, e ∗∗∗ denotam p < 0.05, p < 0.01, e p < 0.001 em comparação com o grupo 0-21 depois do teste Kruskal-Wallis, seguido do teste post-hoc de Dunn. Não foram encontradas diferenças entre os grupos que correram durante 7 dias. Tamanho das amostras (neurônios / ratos): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21), e 15/3 (0-21). As barras horizontais denotam média ± SEM. Círculos abertos correspondem a neurônios de exemplo.
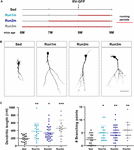
Figura 2. Efeitos da execução em diferentes coortes neuronais. (A) Desenho experimental. A injeção de RV-GFP foi seguida por 3 semanas de corrida e precedida por condições sedentárias (Run1m), 1 (Run2m), ou 2 meses de corrida (Run3m). Todos os grupos foram comparados com ratos sedentários (Sed). O comprimento dendrítico total foi analisado a 21 dpi. (B) Imagens confocais representativas GFP-GCs. Barra de escalas, 50 μm. (C) Complexidade dendrítica (comprimento e pontos de ramificação) para as diferentes janelas de execução. ∗, ∗∗, e ∗∗∗ denotam p < 0.05, p < 0.01, e p < 0.001 em comparação com Sed após o teste Kruskal-Wallis, seguido pelo teste pós-hoc de Dunn. Tamanho das amostras (neurónios/ratos): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m), e 15/3 (Run3m). As barras horizontais denotam média ± SEM. Círculos abertos correspondem a neurônios de exemplo.

Figura 3. Efeitos persistentes do exercício crónico. (A) Desenho experimental. A injeção de RV-GFP foi seguida por 3 semanas de corrida (Run1m) ou precedida por 1 mês de exercício (Run-1m) ou 1 mês de exercício e 1 mês sem a roda de corrida (Run-2m). Todos os grupos foram comparados com ratos sedentários (Sed). O comprimento dendrítico total foi analisado a 21 dpi. (B) Imagens confocais representativas de GCs rotulados. Barra de escalas, 50 μm. (C) Complexidade dendrítica (comprimento e pontos de ramificação) para as diferentes janelas em execução. ∗∗∗ denota p < 0,001 comparado ao Sed após o teste de Kruskal-Wallis seguido do teste pós-hoc de Dunn. Tamanhos de amostra (neurónios/ratos): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m), e 18/3 (Run-2m). (D) A morfologia da MFB no CA3 foi analisada para os grupos Run1m e Run-1m e comparada com a de Sed. Imagens confocais representativas. Barra de escalas, 5 μm. (E) ∗ e ∗∗ denotam p < 0,05 e p < 0,01 após o teste de Kruskal-Wallis seguido do teste pós-hoc de Dunn. Tamanhos das amostras: 27/4 (Sed), 32/4 (Run1m), e 18/4 (Run-1m). As barras horizontais denotam média ± SEM. Os círculos abertos correspondem a boutons exemplo.
Immunofluorescência
Immunostaining foi feito em 60-μm seções coronais flutuantes livres. Foram aplicados anticorpos em solução salina tris-buffered (TBS) com 3% de soro de burro e 0,25% de Triton X-100. A imunofluorescência foi realizada usando anti GFP (policlonal de coelho; 1:500; Invitrogen), anti NeuN (monoclonal de rato; 1:50; um presente do F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Estados Unidos), anti-corpos Cy3 de burro e anti-corpos Cy5 de burro (1:250; Jackson Immuno Research Laboratories).
Microscopia focal
Para medições de comprimento dendrítico, foram adquiridas imagens (40×; NA 1,3; imersão em óleo) de secções espessas de 60-μm tomando pilhas Z incluindo 35-50 fatias ópticas, unidade arejada = 1 a intervalos de 0,8-μm (Trinchero et al., 2017). O comprimento dendrítico foi então medido usando o software LSM Image Browser a partir de projeções de reconstruções tridimensionais para um único plano em GCs expressando GFP. Imagens de MFBs marcados com GFP na região CA3 foram adquiridas em intervalos de 0,4-μm (63×; NA 1,4; imersão em óleo) e um zoom digital de 6. Área e número de filopódios foram analisados a partir de projeções de reconstruções tridimensionais em um único plano. Foram selecionados, para quantificação, os boutons de fibras mussy (MFB) que se encaixam nos seguintes critérios: (i) o diâmetro do bouton era >três vezes maior que o diâmetro da fibra, (ii) o bouton estava ligado à fibra mussy em pelo menos uma extremidade (Toni et al., 2008). Filopódios foram identificados como protuberâncias provenientes de grandes terminais mossy (1 μm < comprimento < 20 μm) (Acsady et al., 1998). As extensões filopodiais foram medidas contando o número de protuberâncias por terminal. Para captura de imagens e análise das propriedades morfológicas, todos os grupos experimentais em estudo foram cegos para o operador.
Análise estatística
Sem especificação em contrário, os dados são apresentados como média ± SEM. A normalidade foi avaliada através dos testes Shapiro-Wilks, D’Agostino-Pearson omnibus e Kolmogorov-Smirnov, com um valor de p de 0,05. Quando os dados se encontravam nos testes de normalidade (distribuição Gaussiana e igual variância), foi utilizado o teste t não pareado com correção de Welch ou ANOVA com teste pós-hoc de Bonferroni, conforme indicado. Nos casos que não atingiram a normalidade, foram utilizados testes não-paramétricos, como a seguir: Investigamos agora se este tipo de plasticidade exige um nível persistente de atividade que se acumula no tempo, ou se períodos mais curtos de execução também podem desencadear uma integração mais rápida, como observado anteriormente para a exposição a EE (Trinchero et al., 2019). Para abordar esta questão, novos coortes neuronais foram rotulados em ratos de meia idade (8 meses de idade; 8M) usando um retrovírus expressando GFP (RV-GFP). Os ratos foram autorizados a usar uma roda de corrida por 1 semana dentro de diferentes janelas de desenvolvimento neuronal, ou a correr durante todo o intervalo de crescimento neuronal (3 semanas; Figuras 1A,B). Como descrito anteriormente, os novos GC apresentaram desenvolvimento lento em ratos sedentários, o que resultou em dendritos curtos com poucas ramificações às 3 semanas. Uma semana consecutiva não alterou a aparência geral dos novos GC em nenhum dos intervalos testados (Figuras 1C,D). Em contraste, a corrida por todo o intervalo de 3 semanas resultou em aumento da extensão dendrítica e ramificação, consistente com uma integração neuronal acelerada.
Os efeitos observados do exercício foram testados em uma única coorte neuronal, aquela que foi rotulada retroviralmente. Entretanto, como novos GCs estão sendo gerados continuamente, é concebível que GCs nascidos em diferentes momentos dentro do período do exercício também possam ser influenciados pela atividade. Para testar esta hipótese, usamos uma estratégia simples para rotular coortes neuronais nascidas em diferentes momentos em relação ao início do exercício, expondo os ratos a rodas de corrida por diferentes intervalos, mas sempre analisando a estrutura neuronal 3 semanas após a injeção retroviral (chamada de 1m para simplicidade). Três coortes foram assim comparadas; uma correndo por 3 semanas, rotulada logo no início do exercício (Run1m), uma correndo por 2 meses, rotulada 1 mês após o início do exercício (Run2m), e uma correndo por 3 meses, rotulada 2 meses após o início do exercício (Run3m) (Figura 2A). Observamos um grau semelhante de crescimento neuronal em todas as condições em comparação com ratos sedentários, o que indica que todos os coortes neuronais nascidos no cérebro de um rato de meia-idade executando corrida voluntária irão sofrer um rápido crescimento e integração (Figuras 2B,C). As árvores dendríticas dos GC em camundongos Run3m eram ligeiramente mais longas que as dos ratos Run1m ou Run2m, sugerindo que a promoção da integração neuronal poderia responder a um mecanismo cujo efeito se acumula no tempo. No entanto, 1 mês de corrida resultou em um efeito quase máximo no desenvolvimento de GC.
Nós então investigamos os efeitos do exercício no cérebro envelhecido sobre os coortes neuronais nascidos uma vez que a atividade terminou. Comparamos como a corrida por 3-4 semanas influencia o desenvolvimento de novos GC nascidos logo no início (Run1m), no final (Run-1m), ou 1 mês após o final do exercício (Run-2m; Figura 3A). Surpreendentemente, as coortes neuronais nascidas no início ou no final do período de corrida responderam de forma semelhante (Figuras 3B,C). Em contraste, as coortes nascidas 1 mês após o final do exercício (Run-2m) mostraram apenas um efeito sutil.
Para se integrar totalmente ao circuito, os GC estabelecem conexões excitatórias glutamátricas em células piramidais CA3 através de grandes MFBs, e recrutam a inibição GABAergic feedforward nas células piramidais através de extensões filopodiais que surgem a partir desses terminais (Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Enquanto a análise confocal não revelou mudanças na área de MFBs de neurônios nascidos em Run-1m ou Run1m em relação aos controles, o número de filopódios/MFBs aumentou em ∼100% (Figuras 3D,E). Esses resultados indicam que o exercício físico aumenta especificamente a conectividade de novos GCs para a rede local inibitória (Trinchero et al., 2019).
Discussão
Neurogênese adulta envolve uma seqüência de etapas complexas de desenvolvimento que resulta na integração de novas unidades de processamento de informação. As células-tronco neurais da zona subgranular deixam seu estado quiescente para se tornarem células progenitoras neurais proliferadoras que expandem a população precursora (células amplificadoras de trânsito) (Bonaguidi et al., 2012). As células progenitoras geram neurônios que migram, se desenvolvem e se integram ao circuito. Durante esta janela de tempo prolongada há uma redução acentuada do pool neuronal devido à morte das células apoptóticas. O exercício voluntário e o EE constituem fortes estímulos para impulsionar a neurogênese hipocampal adulta em roedores ao longo da vida (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). A neurogênese diminui no cérebro envelhecido, principalmente como consequência da redução do tamanho do pool de células progenitoras. Tanto a corrida quanto o EE podem neutralizar a diminuição da produção neuronal relatada em animais idosos, agindo através de diferentes mecanismos (Kempermann et al., 2010). O running age em dois níveis para melhorar a neurogenese: aumentando a taxa de proliferação de células progenitoras neurais (van Praag et al., 1999b, 2005; Cooper et al., 2018), e acelerando a maturação e integração funcional dos neurônios em desenvolvimento (Trinchero et al., 2017). EE aumenta a sobrevivência e também acelera a maturação de novos GC, mas não influencia a proliferação (Trinchero et al., 2017, 2019).
A execução também promove a recabeamento da conectividade neuronal e a modulação das propriedades intrínsecas em novos GC durante a primeira semana de desenvolvimento em ratos jovens adultos (Sah et al., 2017). Recentemente relatamos um período crítico durante a segunda semana de maturação dos GCs em animais idosos, no qual EE induz crescimento dendrítico e integração mais rápida de novos neurônios no circuito (Trinchero et al., 2019). Perguntamos aqui se correr por 1 semana em qualquer momento do desenvolvimento dos GC afetaria sua integração, mas não encontramos nenhum efeito (Figura 1). Todo o período de 3 semanas de funcionamento foi necessário para regular a neurogênese. A falta de modulação de curto prazo sugere um mecanismo mediado por fatores que precisam ser construídos para exercer mudanças perceptíveis. Curiosamente, o exercício voluntário exacerba a produção de BDNF, que se acumula ao longo de semanas antes de atingir um nível de platô que exerce ações máximas (Vecchio et al., 2018). Ainda que as neurotrofinas sejam mediadoras fundamentais, os efeitos aqui observados são plausíveis de serem mediados por múltiplos mecanismos. O exercício também estimula a atividade elétrica no giro dentado, aumenta o fluxo sanguíneo e modula a neuroinflamação (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). A contribuição de outros mecanismos requer mais estudos.
Mostramos aqui que ∼3 os GCs da semana de idade de ratos idosos cronicamente expostos a uma roda de corrida (até 3 meses) apresentam um fenótipo totalmente desenvolvido com arborizações dendríticas longas e complexas, semelhantes às dos novos GC gerados em ratos adultos jovens (Figura 2). Os GC maduros em ratos adultos jovens e de meia idade atingem comprimento dendrítico e complexidade equivalentes no final do desenvolvimento, comparáveis aos GC de 3 semanas em ratos idosos expostos a EE ou em corrida (Piatti et al., 2011; Trinchero et al., 2017, 2019). Esta evidência acumulada fala por uma clara aceleração na velocidade de maturação evocada pela corrida.
Ao nível do output neuronal, a corrida promoveu o rápido crescimento de extensões filopodiais mas não modificou o tamanho dos MBFs (Figuras 3D,E). Este resultado sugere que novos GCs se integram rapidamente, mas seu output pode ser tendencioso para a ativação de interneurônios GABAergic em CA3 (contatados por filopodia), ao invés de células piramidais contatadas por MFBs (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). É surpreendente que o EE tenha provocado um aumento marcado tanto no tamanho das BDMs quanto no número de extensões filopodiais em ratos idosos, consistente com uma modulação mais equilibrada da produção neuronal (Trinchero et al., 2019). Especulamos que mudanças devidas a EE envolvem remodelação dependente de atividade de sinapses específicas que se fortalecem para codificar sinais espaciais (Nicoll e Schmitz, 2005; Holtmaat e Svoboda, 2009). Em contraste, a execução pode representar um estímulo geral para que novos GC se tornem preparados para se conectar a alvos específicos quando a codificação se torna necessária, enquanto conserva o tom inibitório dos interneurônios GABAergicos que podem agir como um mecanismo limitando a atividade pós-sináptica até que o novo GC tenha sido devidamente montado dentro da rede circundante.
Nossos resultados indicam que o cérebro envelhecido gera sinais neurogênicos quando os ratos continuam a funcionar por períodos prolongados (meses). Neste contexto, coortes neuronais subseqüentes nascidos em ratos em funcionamento se desenvolverão e se integrarão rapidamente, permitindo que os circuitos de envelhecimento acumulem um número substancial de novos neurônios (Figura 4). A incorporação contínua de novos GC com características semelhantes ao que ocorre em ratos mais jovens resulta em um hipocampo rejuvenescido com neurônios que poderiam ser preparados para responder a experiências futuras.
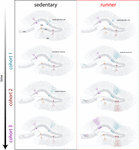
Figure 4. Rejuvenescimento induzido pela circulação da rede hipocampal em ratos de meia-idade. Representação esquemática do curso temporal da integração neuronal em ratos sedentários (esquerda) e em corrida (direita) após intervalos prolongados de exercício voluntário. Na zona subgranular do giro dentado, as células do tipo radial-glia (RGL) permanecem em estado quiescente (topo). Ratos idosos sedentários apresentam baixas taxas de neurogênese e novos neurônios se desenvolvem de forma lenta (coortes representativas são indicadas com cores diferentes). Em ratos em funcionamento, a produção de novos GC é impulsionada, e essas novas unidades se desenvolvem e se integram mais rapidamente, expandindo a rede neural de forma cumulativa ao longo de um período de tempo prolongado. Finalmente, esses novos coortes de neurônios totalmente maduros tornam-se engajados para processar informações sob demanda.
De uma perspectiva mais ampla, o aumento da longevidade associada à sociedade moderna é acompanhado por um maior risco de declínio cognitivo. Assim, torna-se relevante compreender os mecanismos subjacentes aos bem conhecidos benefícios do exercício da função cerebral. Além disso, pode haver diferenças de longo prazo entre os indivíduos que praticam exercício durante diferentes intervalos na vida e aqueles que fizeram exercício continuamente, em termos de diminuição do risco de desenvolver doenças neurodegenerativas (Llorens-Martin, 2018). Nossos resultados demonstram que a corrida contínua promove a integração de muitos coortes neuronais, elevando assim a complexidade da rede de uma forma notável. O desenho de diferentes estratégias para aumentar a eficácia da integração de novos neurônios no hipocampo pode servir como um promissor mecanismo de plasticidade para eventualmente melhorar o declínio cognitivo que ocorre no cérebro saudável e doente em envelhecimento. Finalmente, dissecar os mecanismos subjacentes aos diferentes aspectos dessa integração e desenvolvimento neuronal acelerado nos ensinará muito sobre o potencial de plasticidade das redes neurais no cérebro envelhecido.
Data Availability
Os dados que suportam os achados deste estudo estão disponíveis no autor correspondente mediante solicitação razoável.
Declaração Ética
O estudo animal foi revisado e aprovado pelo comitê de uso e cuidado de animais de laboratório do Instituto Leloir.
Autor Contribuições
MT e MH realizaram os experimentos e analisaram os dados. MT, MH, e AS desenharam os experimentos e escreveram o manuscrito. AS forneceu apoio financeiro.
Funding
Este trabalho foi apoiado pela Agência Argentina de Promoção da Ciência e Tecnologia (Grant# PICT2015-3814), o Instituto Nacional de Distúrbios Neurológicos e do AVC, e o Centro Internacional Fogarty (Grant# R01NS103758) para AS, que é investigador no Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT foi apoiado por uma bolsa CONICET.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Administrações
Agradecemos aos membros do AS lab. de investigação por discussões aprofundadas.
Acsady, L., Kamondi, A., Sik, A., Freund, T., e Buzsaki, G. (1998). As células GABAergicas são os principais alvos pós-sinápticos das fibras musculares no hipocampo do rato. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Evidência autorradiográfica e histológica da neurogênese hipocampal pós-natal em ratos. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., e Wulff, P. (2015). O hipocampo no envelhecimento e na doença: da plasticidade à vulnerabilidade. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). Uma hipótese unificadora sobre as propriedades das células-tronco neurais dos mamíferos no hipocampo adulto. Moeda. Opinião. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., e Barnes, C. A. (2006). Plasticidade neural no cérebro envelhecido. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., e Barnes, C. A. (2010). Sinapses senescentes e dinâmica do circuito hipocampal. Tendências neurocientíficas. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Memória, navegação e ritmo teta no sistema hipocampal-entorhinal. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., e van Praag, H. (2018). Em fuga para a plasticidade hipocampal. Cold Spring Harb. Perspicaz. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., e Sendtner, M. (2016). O exercício físico na velhice pode melhorar a memória e a função hipocampal? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogênese no hipocampo humano adulto. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., e Villeda, S. A. (2017). Mecanismos do envelhecimento hipocampal e o potencial de rejuvenescimento. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). A neurogenese hipocampal do adulto correlaciona-se inversamente com a microglia em condições de corrida voluntária e de envelhecimento. Frente. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., e Svoboda, K. (2009). Plasticidade sináptica estrutural dependente da experiência no cérebro dos mamíferos. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). A corrida reduz o estresse e melhora a gênese celular em ratos idosos. Neurobiol. Ageing 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Porquê e como a actividade física promove a plasticidade cerebral induzida pela experiência. Frente. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., e Gage, F. H. (1998). Neurogênese induzida pela experiência no giro denteado senescente. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., e Kempermann, G. (2006). O exercício físico previne o declínio da atividade das células precursoras no giro dentado do rato relacionado com a idade. Neurobiol. Idade 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulações de células proliferantes do hipocampo adulto respondem de forma diferente a estímulos neurogênicos fisiológicos. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., e Gage, F. H. (1996). Neurogênese no giro dentado do rato adulto: diminuição da proliferação de progenitores neuronais relacionada à idade. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Exercitando novos neurônios para vencer a doença de Alzheimer. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., e van Praag, H. (2012). Correr através da meia-idade melhora a função de memória, neurogênese hipocampal, e níveis de BDNF em ratos C57BL/6J fêmeas. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). A neurogênese hipocampal não é necessária para efeitos comportamentais de enriquecimento ambiental. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). A neurogênese hipocampal adulta é abundante em indivíduos neurologicamente saudáveis e cai acentuadamente em pacientes com doença de Alzheimer. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., e Schinder, A. F. (2008). Células de grânulos recém-nascidos no giro dentado envelhecido. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., e Schmitz, D. (2005). Plasticidade sináptica em sinapses hipocampais de fibras musculares. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., e Kelly, A. M. (2009). A exposição a longo prazo em esteira protege contra alterações neurodegenerativas relacionadas com a idade no hipocampo do rato. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., e Franklin, K. B. J. (2001). O Cérebro do Rato em Coordenadas Estereotáxicas. Amesterdão: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., e Schinder, A. F. (2011). O momento da maturação neuronal no hipocampo adulto é modulado pela atividade da rede local. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., e Frankland, P. W. (2015). Desenvolvimento da conectividade celular gerada por adultos com populações de células excitatórias e inibitórias no hipocampo. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., e van Praag, H. (2017). Running reorganiza os circuitos dos neurônios hipocampais nascidos no adulto com uma semana de vida. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., e Ormerod, B. K. (2013). O exercício diário melhora a memória, estimula a neurogênese hipocampal e modula as citocinas imunes e neuroimunes em ratos idosos. Comportamento Cerebral. Imune. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Reconstrução sem costura de neurônios nascidos em adultos intactos através de imagens em série de blocos terminais revela orientação axonal complexa e desenvolvimento no hipocampo adulto. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neurônios nascidos no giro dentado adulto formam sinapses funcionais com células-alvo. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Alta plasticidade da nova célula granular no hipocampo envelhecido. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., e Schinder, A. F. (2019). Plasticidade estrutural dependente da experiência de neurônios nascidos no adulto no hipocampo envelhecido. Frente. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). A execução melhora a neurogênese, a aprendizagem e a potenciação a longo prazo em ratos. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., e Gage, F. H. (1999b). A execução aumenta a proliferação celular e a neurogênese no giro dentado do rato adulto. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., e Gage, F. H. (2005). O exercício melhora a aprendizagem e a neurogênese hipocampal em camundongos idosos. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., e Aubert, I. (2018). Os efeitos neuroprotectores do exercício: manter um cérebro saudável durante todo o envelhecimento. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). O exercício aumenta a proliferação de células-tronco neurais e o crescimento e sobrevivência de células progenitoras neuronais no giro dentado de camundongos de meia idade. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., e Hen, R. (2015). Running resgata um déficit de discriminação contextual baseada no medo em ratos idosos. Frente. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). A melhoria da memória induzida pela execução correlaciona-se com a preservação de espinhas finas na área hipocampal CA1 dos antigos ratos C57BL/6. Neurobiol. Envelhecimento 52, 106-116. doi: 10.1016/j.neurobiolage.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




