CHEM 101 – Electroliți
TEMATICI DE CHIMIE GENERALĂ
Electroliți
Disocierea compușilor ionici în apă duce la formarea de specii ionice apoase mobile.Ecuații chimice pentru dizolvarea și disocierea în apă. Electroliți puternici și electroliți slabi.
Electroliții (acompaniament muzical la acest subiect) sunt substanțe care creează specii ionice în soluție apoasă. Existența purtătorilor de sarcină în soluție poate fi demonstrată cu ajutorul unui experiment simplu. Conductivitatea mediilor apoase poate fi observată prin utilizarea unei perechi de electrozi, conectați la o sursă de tensiune, care sunt scufundați în soluție. Curentul pe care îl conduce soluția poate fi măsurat cu ușurință, iar un bec luminos poate fi utilizat ca indicator vizual al conductivității unei soluții.
Când acest experiment este realizat cu apă pură, becul nu luminează deloc. Apa în sine nu conduce cu ușurință electricitatea; este un exemplu de substanță moleculară care este un neelectrolit. Acest lucru este valabil și pentru multe alte substanțe moleculare. De exemplu, zahărul de masă (zaharoză, C12H22O11) – este destul de solubil în apă, dar o soluție de zahăr aparent nu conduce electricitatea mai bine decât doar apa singură. Pe de altă parte, atunci când efectuăm experimentul cu un compus ionic liber solubil, cum ar fi clorura de sodiu, becul luminează puternic.
Să reprezentăm ceea ce credem că se întâmplă cu aceste cazuri contrastante de dizolvare a unui compus molecular și a unui compus ionic prin scrierea următoarelor ecuații chimice:
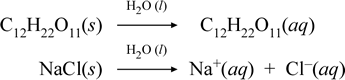
Prima ecuație de mai sus reprezintă dizolvarea unui neelectrolit, compusul molecular zaharoză. A doua ecuație reprezintă dizolvarea unui compus ionic, clorura de sodiu. în acest caz, distincția cheie dintre cele două ecuații chimice este formarea în cea din urmă a unor specii ionice apoase ca produse. Ionii sunt liberi să difuzeze individual într-un amestec omogen, iar atunci când se aplică o tensiune, ionii se vor deplasa în funcție de diferența de energie potențială electrică între electrozi, transportând astfel curent electric. Observați că apa nu este reprezentată pe partea reactantă a acestor ecuații, ci este prezentată deasupra săgeții, ceea ce indică faptul că apa determină mediul în care are loc procesul de dizolvare. Statutul superstoichiometric al apei în această simbolistică poate fi citit ca un proces de dizolvare care are loc cu apa ca solvent. Nu vom scrie apa ca un reactant în formarea unei soluții apoase printr-un simplu proces de dizolvare. Există multe cazuri în care o substanță reacționează cu apa pe măsură ce se amestecă și se dizolvă în apă. Această reacție a unui solut în soluție apoasă dă naștere la produse distincte din punct de vedere chimic. În astfel de cazuri, apa poate fi prezentată în mod explicit în ecuația chimică ca specie reactantă.
Electroliți puternici și slabi
Se pare că atunci când un compus ionic solubil, cum ar fi clorura de sodiu, suferă dizolvare în apă pentru a forma o soluție apoasă formată din ioni solvatați, săgeata spre dreapta folosită în ecuația chimică este justificată prin faptul că (atâta timp cât nu s-a atins limita de solubilitate) clorura de sodiu solidă adăugată în apa solventă se disociază complet. Cu alte cuvinte, există efectiv o conversie de 100% a NaCl(s) în Na+(aq) și Cl-(aq). Ca urmare, în experimentul nostru de conductivitate, o soluție de clorură de sodiu este foarte conductivă datorită abundenței de ioni, iar becul luminează puternic. Într-un astfel de caz, spunem că clorura de sodiu este un electrolit puternic.
În contrast, să luăm în considerare substanța moleculară acidul acetic, HC2H3O2.Când acidul acetic este dizolvat în apă, el formează o specie moleculară nedisociată, solubilă, simbolizată ca HC2H3O2(aq), similar cu cazul cu zaharoza de mai sus. Cu toate acestea, atunci când efectuăm testul de conductivitate cu o soluție de acid acetic, constatăm că becul luminează, deși destul de slab în comparație cu strălucirea observată pentru soluția de clorură de sodiu. În acest caz, trebuie să existe cel puțin o formare parțială de ioni din acid acetic în apă. O ecuație chimică care să reprezinte acest proces trebuie să arate producerea de ioni. O propunere rezonabilă pentru o astfel de ecuație ar fi:
![]()
Două lucruri sunt importante de reținut aici. În primul rând, acesta este un caz în care includem apa ca reactant. Cele două substanțe moleculare, apa și acidul acetic, reacționează pentru a forma ionii poliatomici hidroniu și acetat. Ecuația care reprezintă acest lucru este o ecuație ionică. A doua trăsătură care merită discutată în continuare este înlocuirea săgeții spre dreapta cu simbolul săgeților duble cu o singură bară, care semnifică un echilibru chimic și, în acest caz, condiția de echilibru pentru reacție favorizează reactanții, ceea ce înseamnă că, într-o soluție apoasă de acid acetic, cea mai mare parte a acidului acetic rămâne sub formă de molecule de acid acetic, doar o mică parte a cedat în orice moment H+ către apă pentru a forma ionii. Numărul mic de ioni produși explică de ce soluția de acid acetic nu conduce electricitatea la fel de bine ca soluția de clorură de sodiu, rezultând doar o iluminare slabă a becului luminos al detectorului nostru de conductivitate. Prin urmare, facem o distincție între electroliții puternici, cum ar fi clorura de sodiu, și acidul acetic, care este un exemplu de electrolit slab.
Așa cum sugerează și numele de acid acetic, această substanță este, de asemenea, un acid, precum și un electrolit slab. În consecință, clasificăm acidul acetic ca fiind un acid slab. Prima noastră definiție (și cea mai puțin generală) a unui acid este o substanță care creează ioni de hidroniu în apă, ceea ce este exact ceea ce arată ecuația noastră ionică de mai sus, ținând cont de faptul că un acid slab creează cantități relativ mici de ioni de hidroniu.
Cimiștii sunt foarte pasionați de abrevieri, iar o abreviere importantă pentru ionul de hidroniu este H+(aq), iar aceasta este folosită în mod obișnuit. Acest lucru este ilustrat în versiunea prescurtată a ecuației de mai sus, care este prezentată chiar mai jos. Pentru a fi clar, H+ în sine ar fi doar un proton izolat (pentru 1H); prin urmare, este, de asemenea, important de remarcat faptul că nu există o astfel de specie în soluție apoasă.
În plus, săgețile au fost făcute de lungimi inegale pentru a indica echilibrul favorizat de reactant, în care există mult mai puțini ioni decât molecule de acid acetic.
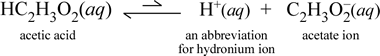
Prin reprezentarea hidroniului ca H+(aq), ecuația ionică pentru acidul acetic în apă este echilibrată formal fără a include o moleculă de apă ca reactant, ceea ce este implicit în ecuația de mai sus.
Amonia: Un exemplu de electrolit slab care este o bază slabă
Acidul acetic, așa cum tocmai am văzut, este un compus molecular care este un acid și un electrolit slab. Amoniacul, NH3, un alt compus molecular simplu, reacționează, de asemenea, într-o mică măsură cu apa, formând ioni de amoniu și hidroxid. Prima noastră definiție, cea mai puțin generală, a unei baze este o substanță care creează ioni de hidroxid în apă. Astfel, amoniacul este o bază slabă și, ca și acidul acetic, nu conduce electricitatea nici pe departe la fel de bine ca o sare apoasă. Așadar, amoniacul este și el un electrolit slab.
![]()
Simbolismul ecuației noastre chimice indică din nou un echilibru favorizat de reactant pentru electrolitul slab.
Extensiuni și conexiuni
O abordare mai cantitativă a echilibrelor folosește acizii slabi și bazele slabeca exemple importante.
.




