CHEM 245 – Inhibiția enzimatică
TEMATICA BIOCHIMIE
Inhibiția enzimatică
Tipuri de inhibitori și inhibiție.Inhibitori și inhibiție reversibilă și ireversibilă. Modele pentru și efecte cinetice ale inhibiției competitive și necompetitive. Inhibiție mixtă.Exemple de inhibiție enzimatică.
Specificitatea enzimelor nu se limitează strict la substraturi. Adesea, activitatea unei enzime este redusă prin interacțiuni specifice cu molecule numite inhibitori. Inhibiția enzimatică este unul dintre cele mai importante fenomene din biochimie. De exemplu, multe medicamente, antibiotice și toxine își exercită efectele prin capacitatea lor de a inhiba o enzimă. Inhibitorii care sunt asemănători din punct de vedere structural cu substratul sunt adesea inhibitori competitivi, deoarece concurează pentru legarea la situsul activ. Inhibarea enzimei poate fi reversibilă (așa cum se întâmplă de obicei atunci când un inhibitor se leagă de enzimă prin interacțiuni necovalente) sau ireversibilă (așa cum se întâmplă în numeroase cazuri în care inhibitorii acționează prin modificări covalente ale enzimei, poate vizând un reziduu critic pentru cataliză).
Ne putem imagina câteva modele simple pentru inhibiția reversibilă. Cel mai simplu dintre acestea este ocluzia directă a situsului activ de către inhibitor. Acest lucru s-ar vedea în cazul unei molecule cu o anumită similaritate structurală cu substratul. Legarea substratului și a inhibitorului se exclud reciproc în acest model de inhibiție competitivă.
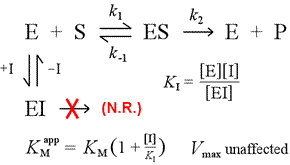
În dreapta este prezentat un model mecanicist simplu pentru inhibiția competitivă. Inhibitorul, I, se leagă numai de enzima liberă E, cu o constantă de disociere KI , și blochează legarea substratului (S). Prin blocarea unei părți din enzimă în complexul inactiv EI, la o anumită concentrație de substrat, o cantitate mai mică de enzimă este disponibilă pentru a se combina cu substratul și a forma ES și apoi pentru a se transforma potențial în produse. Se va observa o creștere a cantității necesare pentru a atinge ½Vmax, de aceea valoarea aparentă a KM crește.
Crescând la niveluri din ce în ce mai mari, substratul poate copleși inhibitorul, depășindu-l pe acesta pentru enzima liberă în măsura în care adevărata Vmax poate fi încă apropiată.
Ne putem imagina cu ușurință că o moleculă care seamănă cu substratul în anumite caracteristici structurale cheie ar putea concura cu substratul pentru legarea la la situsul activ. Acest lucru se numește analog al substratului, iar acestea oferă exemple comune de inhibitori competitivi ai enzimelor. Dacă modul în care enzimele sporesc viteza de reacție este stabilizarea selectivă a stării de tranziție a reacției, atunci, dacă putem găsi o moleculă care seamănă cu starea de tranziție (în structură și polaritate sau sarcină), un astfel de analog al stării de tranziție ar trebui să fie un inhibitor competitiv foarte bun.
Vom contrasta modelul de inhibiție competitivă cu cel de inhibiție necompetitivă, în care inhibitorul se leagă doar de complexul enzimă-substrat. Ne putem imagina că acest lucru se întâmplă ca urmare a unei interacțiuni enzimă-substrat de tip „induced-fit”, în care un situs de legare pentru un inhibitor este disponibil exclusiv în conformația indusă a ES.
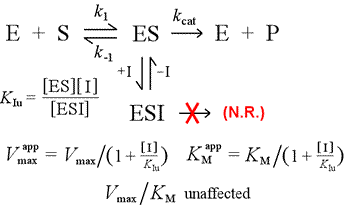
Stânga: Un model mecanicist pentru inhibiția necompetitivă. În acest model, inhibitorul se leagă numai de complexul ES, și nu de enzima liberă. Complexul ternar, ESI, nu trece la produși. Acest lucru are ca efect scăderea Vmax aparentă. Constanta de disociere a inhibitorului pentru ESI este notată KIu. Într-un efect explicat prin principiul lui Le Châtelier, KM aparentă este mai mică, deoarece legarea inhibitorului elimină o parte din produsul (ES) din „echilibrul” de formare a ES.
Un model de inhibiție în care inhibitorul se leagă atât de enzima liberă, cât și de complexul enzimă-substrat este inhibiția mixtă. Constanta de disociere a inhibitorului poate fi diferită între E și ES (adică KI ≠ KIu). Cazul special în care KI = KIu poartă denumirea de inhibiție necompetitivă. Rețineți că, în acest caz, KM nu este afectată, în timp ce Vmax este diminuată.
Tipuri de inhibiție enzimatică reversibilă – un rezumat
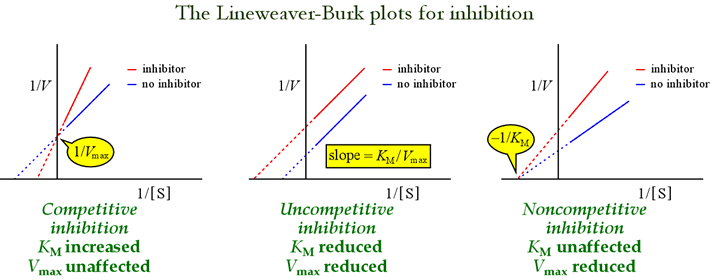
Am văzut că diferitele modele de inhibiție reversibilă pot fi distinse în funcție de efectele asupra parametrilor cinetici. Tabelul de mai jos sintetizează tipurile de inhibiție și efectele lor asupra acestor parametri.

Paragramele Lineweaver-Burk, sau dublu-reciprocice sunt utile pentru identificarea modelelor de inhibiție. Figura de mai jos aratăcum afectează graficul diferite tipuri de inhibiție.
Exemple de inhibiție enzimatică
Primul și cel mai utilizat medicament, acetilsalicilatul (salicilat = ortohidroxibenzoat), cunoscut în mod obișnuit sub numele de aspirină, este un analgezic (calmant al durerii), antipiretic (reductor al febrei) și antiinflamator eficient. Proprietățile medicinale ale scoarței de salcie erau cunoscute de secole în unele culturi. În secolul al XIX-lea, s-a descoperit că ingredientul activ este o combinație de și alcool salicilic. Pe baza acestor observații și a altor observații, precum și a progreselor în domeniul sintezei chimice, aspirina a devenit disponibilă la mijlocul secolului trecut, fiind preparată de Hoffman, un chimist angajat de Bayer. Cercetări mai moderne au stabilit că proprietățile medicinale ale aspirinei derivă în mare parte din capacitatea sa de a inhiba ireversibil o enzimă cunoscută sub numele de ciclooxigenază, care este necesară pentru sinteza prostaglinelorși a tromboxanilor.
Ciclooxigenazele catalizează primul pas în conversia arahidonatului într-un precursor al prostaglandinelor și tromboxanilor, prostaglandina G2 (PGG2, structuri și reacție). Reacția utilizează două molecule de O2 și transformă acidul gras C20:4 într-o moleculă peroxidată care conține un inel ciclopentanic (PGG2 – PG înseamnă „prostaglandină”). Enzima ciclooxigenază posedă, de asemenea, o activitate de hidroperoxidază care transformă PGG2 în PGH2. Astfel, „ciclooxigenaza” (COX) ar fi desemnată mai exact ca prostaglandină endoperoxid H sintetază (PGHS). Inhibarea activității ciclooxigenazei de către aspirină se datorează capacității acesteia de a modifica chimic un reziduu de serină (Ser530) al enzimei. Reziduul serină dobândește o grupare acetil de la aspirină, o modificare ireversibilă. Astfel, aspirina este un exemplu de inhibitor ireversibil. Există de fapt două izozime COX: o formă constitutivă, COX-1 (PGHS-1), și o formă indusă (în condiții de inflamație), COX-2 (PGHS-2). Medicamentele antiinflamatoare nesteroidiene (AINS), cum ar fi aspirina, ibuprofenul și naproxenul, inhibă în general ambele izoforme. În consecință, aceste medicamente produc efecte secundare nedorite, de exemplu, iritații gastrointestinale. Astfel, un obiectiv actual al cercetării farmacologice este de a dezvolta inhibitori specifici pentru COX-2, un efect despre care se crede că mediază majoritatea efectelor analgezice și antiinflamatorii ale AINS.
Pagini cu subiecte conexe:
- introductory chemical kinetics
- introductory enzymology
- enzyme kinetics
- Michaelis-Menten equation
.




