Clorura de sodiu, NaCl
Caz clasic de legătură ionică, molecula de clorură de sodiu se formează prin ionizarea atomilor de sodiu și clor și prin atracția ionilor rezultați.
Un atom de sodiu are un electron 3s în afara unui înveliș închis și este nevoie de numai 5,14 electronvolți de energie pentru a elimina acel electron. Clorului îi lipsește un electron pentru a umple un înveliș și eliberează 3,62 eV atunci când dobândește acel electron (afinitatea sa electronică este de 3,62 eV).Aceasta înseamnă că este nevoie de numai 1,52 eV de energie pentru a dona unul dintre electronii de sodiu clorului atunci când aceștia sunt la mare distanță unul de celălalt. Atunci când ionii rezultați sunt aduși mai aproape unul de celălalt, energia lor potențială electrică devine din ce în ce mai negativă, ajungând la -1,52 eV la o distanță de aproximativ 0,94 nm. Acest lucru înseamnă că, dacă atomii neutri de sodiu și de clor s-ar afla mai aproape de 0,94 nm, ar fi favorabil din punct de vedere energetic să se transfere un electron de la Na la Cl și să se formeze legătura ionică.
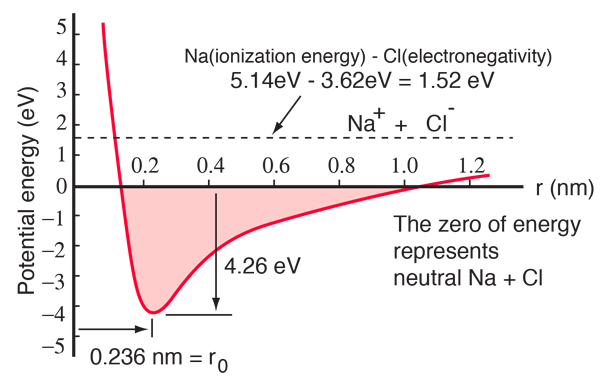
Curba energiei potențiale arată că există un minim la o separare de 0,236 nm și apoi o creștere abruptă a potențialului care reprezintă o forță de respingere. Această forță de respingere este mai mult decât o simplă repulsie electrostatică între norii de electroni ai celor doi atomi. Ea are un caracter mecanic cuantic înrădăcinat în principiul de excludere Pauli și este adesea numită doar „principiul de excludere a repulsiei”. Atunci când ionii sunt foarte despărțiți, funcțiile de undă ale electronilor din nucleul lor nu se suprapun în mod semnificativ și pot avea numere cuantice identice. Pe măsură ce se apropie, suprapunerea din ce în ce mai mare a funcțiilor de undă ale ionilor face ca unii dintre ei să fie forțați să treacă în stări de energie mai ridicată. Nu pot exista doi electroni care să ocupe aceeași stare, astfel încât, pe măsură ce se formează un nou set de stări energetice pentru sistemul compozit cu două nuclee, stările energetice inferioare sunt umplute, iar unii dintre electroni sunt împinși în stări superioare. Acest lucru necesită energie și este resimțit ca o repulsie, împiedicând ionii să se apropie unul de celălalt.
Diagrama de potențial de mai sus este pentru NaCl gazos, iar mediul este diferit în starea solidă normală, unde clorura de sodiu (sarea de masă obișnuită) formează cristale cubice. Separarea ionilor este de 0,28 nm, ceva mai mare decât cea din starea gazoasă.
O parte importantă a studiului structurii moleculare este reprezentată de descrierea legăturilor chimice care se formează între atomi. Studiile clasice sunt extremele legăturilor ionice din clorura de sodiu și legăturile covalente din molecula de hidrogen.
| Legături chimice | Repulsia lui Paul în legăturile ionice |
Exemplu de energie de legătură




