Definiția funcției de undă
Particulele fundamentale, cum ar fi electronii, pot fi descrise ca particule sau ca unde.
Electronii pot fi descriși folosind o funcție de undă. simbolul funcției de undă este litera greacă psi, Ψ sau ψ.

Funcția de undă Ψ este o expresie matematică.Ea poartă informații cruciale despre electronul cu care este asociată:din funcția de undă obținem energia, momentul unghiular și orientarea orbitală a electronului sub forma numerelor cuantice n, l și ml.
Funcția de undă poate avea un semn pozitiv sau negativ.Semnul este important în calcule.Este, de asemenea, important atunci când funcțiile de undă a doi sau mai mulți atomi se combină pentru a forma o moleculă.
Funcțiile de undă cu semne asemănătoare (unde în fază) vor interfera în mod constructiv, ceea ce duce la posibilitatea unei legături.Funcțiile de undă cu semne neasemănătoare (unde defazate) vor interfera în mod distructiv.
În 1926, Erwin Schrödinger a dedus funcția de undă pentru cel mai simplu dintre toți atomii, hidrogenul.Rezolvarea ecuației lui Schrödinger permite oamenilor de știință să determine funcțiile de undă pentru electronii din atomi și molecule.
Ecuația lui Schrödinger este o ecuație de mecanică cuantică: funcțiile de undă calculate au valori discrete, permise pentru electronii legați în atomi și molecule;toate celelalte valori sunt interzise.
În plus față de importanța lui Ψ, pătratul său Ψ2 are, de asemenea, o semnificație enormă în chimie.
Ψ2 este densitatea de probabilitate.Ea ne spune unde este cel mai probabil să se găsească electronul în spațiul din jurul nucleului.
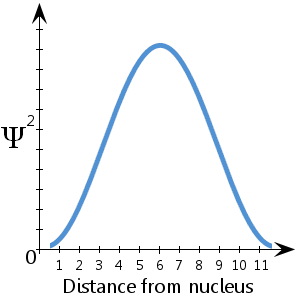
De exemplu, în diagrama schematică (fictivă) reprezentată aici, care arată Ψ2 în funcție de distanța față de nucleu, vedem că electronul are cele mai multe șanse să se găsească între aproximativ 5-7 unități de la nucleu.Vedem, de asemenea, că există o probabilitate extrem de mică ca electronul să se afle la nucleu sau la mai mult de aproximativ 11½ unități distanță de nucleu.
Există o probabilitate de 100% ca electronul să se afle undeva – cu alte cuvinte, o probabilitate de 1.
Ψ poate fi calculată cu exactitate numai pentru atomii cu un singur electron, adică H, He+, Li2+, Be3+, B4+, C5+, etc. În limbaj matematic, spunem că soluțiile analitice pentru Ψ sunt posibile numai pentru sistemele cu un singur electron.Sistemele cu un singur electron sunt adesea descrise ca fiind hidrogenice – ceea ce înseamnă „ca hidrogenul”.”
Pentru toți ceilalți atomi, ioni și molecule, nu sunt posibile soluții analitice pentru Ψ;sunt necesare metode de aproximare pentru a o calcula.
Ψ2 și orbitali hidrogenici
Prin reprezentarea densității de probabilitate a hidrogenului (i.adică Ψ2) pentru diferite numere cuantice ne permite să vizualizăm spațiul, centrat pe nucleu, pe care îl ocupă electronii. diferitele distribuții Ψ2 reprezintă orbitele electronice ale hidrogenului.Orbitalul care este efectiv ocupat este determinat de cantitatea de energie pe care o are electronul.
Exemple de orbitali ai hidrogenului
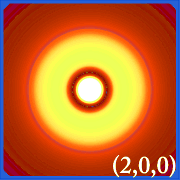
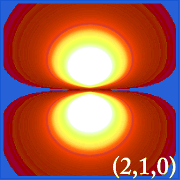

.




.




