Frontiers in Neuroscience
Introducere
Generarea de noi neuroni în hipocampul adult, o regiune a creierului implicată în navigarea spațială și formarea memoriei (Buzsaki și Moser, 2013), este o formă izbitoare de plasticitate care persistă pe tot parcursul vieții la mai multe specii, inclusiv la oameni (Altman și Das, 1965; Eriksson et al., 1998; Moreno-Jiménez et al., 2019). Printre numeroasele condiții care reglează neurogeneza hipocampală adultă, unul dintre cele mai fiabile procese care a fost descris pe scară largă este declinul mediat de vârstă în producția neuronală, în timp ce populațiile neuronale preexistente rămân constante odată cu îmbătrânirea normală (Kuhn și colab., 1996; Kempermann și colab., 1998; Burke și Barnes, 2010). Îmbătrânirea afectează multe funcții ale creierului, inclusiv transmiterea sinaptică și plasticitatea, despre care se crede că contribuie la pierderea memoriei (Burke și Barnes, 2006; Fan et al., 2017). Având în vedere că hipocampul este deosebit de vulnerabil la alterările legate de vârstă și la neurodegenerare, găsirea unor strategii pentru a spori plasticitatea în această structură devine relevantă pentru a preveni sau a atenua efectele senescenței (Bartsch și Wulff, 2015). Exercițiile fizice și stimulii cognitivi îmbunătățesc sănătatea creierului și tind să amelioreze efectele îmbătrânirii. Unul dintre beneficiile directe poate proveni din creșterea dependentă de activitate a nivelurilor factorului neurotrofic derivat din creier (BDNF), care s-a dovedit a restabili plasticitatea sinaptică, a spori neurogeneza și a îmbunătăți învățarea la șoarecii de vârstă mijlocie (Marlatt et al., 2012; Trinchero et al., 2017). Exercițiul fizic reduce, de asemenea, activarea microgliei, crește plasticitatea sinaptică dependentă de activitate, proliferarea celulelor progenitoare neuronale și accelerează dezvoltarea și integrarea celulelor granule (GC) născute la vârsta adultă în hipocampul îmbătrânit (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Aceste efecte contribuie la restabilirea plasticității dependente de hipocamp și se corelează cu comportamentul adaptiv. Astfel, animalele îmbătrânite care au performanțe slabe în sarcinile de învățare spațială și de separare a modelelor, își îmbunătățesc performanțele după exerciții fizice (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
Măsura în care neurogeneza contribuie la efectele comportamentale pozitive ale exercițiilor fizice la animalele îmbătrânite este încă în curs de examinare. Este posibil ca creșterea ratei de neurogeneză exercitată de exercițiul fizic să contribuie la îmbunătățirea comportamentului. Dar pot fi implicate și alte mecanisme (Meshi et al., 2006). Integrarea accelerată a noilor neuroni în girusul dentat îmbătrânit după exerciții fizice, care modifică calitatea noilor GC, poate contribui, de asemenea, la îmbunătățirea comportamentului. În timp ce neuronii născuți la șoarecii de vârstă mijlocie se dezvoltă lent, exercițiile fizice voluntare susținute promovează creșterea dendritică, formarea coloanei vertebrale și integrarea neuronală (Trinchero et al., 2017). Efecte similare au fost observate prin expuneri scurte la îmbogățirea mediului (EE) (Trinchero et al., 2019). Dacă este acumulată pe mai multe cohorte neuronale, integrarea neuronală accelerată declanșată de exercițiu ar putea exercita o influență semnificativă asupra învățării și comportamentului dependent de hipocampus. În această lucrare, demonstrăm că mai multe cohorte de noi GC pot fi integrate rapid în circuitele preexistente ale șoarecilor care continuă să se angajeze în alergare voluntară și că aceste efecte persistă după ce șoarecii au încetat să mai alerge.
Materiale și metode
Mice și chirurgie
Soarecii masculi C57BL/6J au fost adăpostiți la 4-5 animale pe cușcă în condiții standard. Șoarecii în vârstă de opt luni (8M) au fost selectați deoarece, dincolo de această vârstă, există un declin puternic al neurogenezei hipocampale care împiedică studiul neuronilor etichetați (Morgenstern et al., 2008; Trinchero et al., 2017). Șoarecii au fost anesteziați (150 μg de ketamină/15 μg de xilazină în 10 μl de soluție salină/g), iar retrovirusul a fost infuzat în regiunea septală a girusului dentat drept (1,5 μl la 0,15 μl/min) cu ajutorul unor pipete microcapilare sterile calibrate prin chirurgie stereotaxică; coordonate de la bregma (în mm): -2 anteroposterior, -1,5 lateral și -1,9 ventral. La momentele indicate, creierul a fost fixat și secțiunile au fost pregătite pentru imagistica confocală (Trinchero et al., 2017). În analiză au fost incluse doar CG din gyrusul dentat septal, corespunzător secțiunilor localizate de la -0,96 la -2,30 mm de la bregma, conform atlasului creierului de șoarece (Paxinos și Franklin, 2001). Protocoalele experimentale au fost aprobate de către Comitetul instituțional pentru îngrijirea și utilizarea animalelor din cadrul Fundación Instituto Leloir, în conformitate cu Principiile pentru cercetarea biomedicală care implică animale ale Consiliului Organizațiilor Internaționale pentru Științe Medicale și cu prevederile menționate în Ghidul pentru îngrijirea și utilizarea animalelor de laborator.
Cercetare
Distanțele de alergare au fost înregistrate pentru fiecare experiment cu ajutorul roților de alergare fără fir. În experimentele din figura 1, animalele au fost adăpostite cu o roată de alergare timp de 7 sau 21 de zile, după cum este indicat. În aceste condiții, șoarecii au alergat ∼2 km/zi. În figurile 2, 3, în care șoarecii au alergat timp de 1, 2 sau 3 luni, distanța monitorizată a fost de ∼10 km/zi.
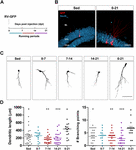
Figura 1. Perioadele lungi, dar nu și cele scurte de alergare, accelerează maturizarea morfologică a noilor GC. (A) Design experimental. Injectarea RV-GFP a fost urmată de expunerea la 1 săptămână de alergare voluntară la ferestrele indicate sau pentru întregul experiment (0-21 dpi). (B) Imagini reprezentative ale GC-urilor de 21 dpi care exprimă GFP (roșu) luate din grupurile sedentare și din grupurile de alergare 0-21. NeuN (albastru) etichetează stratul de celule granulare (GCL) (ML, strat molecular). Bară de scară, 50 μm. (C) Imagini confocale reprezentative ale 21-dpi GFP-GCs pentru diferitele grupuri. Bară de scară, 50 μm. (D) Complexitatea dendritică (lungime și puncte de ramificare) pentru diferitele ferestre de funcționare. ∗, ∗∗ și ∗∗∗∗ denotă p < 0,05, p < 0,01 și p < 0,001 în comparație cu grupul de alergare 0-21 după testul Kruskal-Wallis urmat de testul post hoc Dunn. Nu s-au constatat diferențe între niciunul dintre grupurile care au alergat timp de 7 zile. Dimensiunile eșantioanelor (neuroni/șoareci): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) și 15/3 (0-21). Barele orizontale denotă media ± SEM. Cercurile deschise corespund neuronilor de exemplu.
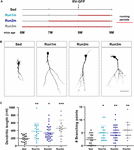
Figura 2. Efectele alergării asupra diferitelor cohorte neuronale. (A) Design experimental. Injectarea RV-GFP a fost urmată de 3 săptămâni de alergare și precedată de condiții sedentare (Run1m), 1 (Run2m), sau 2 luni de alergare (Run3m). Toate grupurile au fost comparate cu șoarecii sedentari (Sed). Lungimea dendritică totală a fost analizată la 21 dpi. (B) Imagini confocale reprezentative GFP-GCs. Bară de scară, 50 μm. (C) Complexitatea dendritică (lungime și puncte de ramificare) pentru diferitele ferestre de alergare. ∗, ∗∗ și ∗∗∗∗ denotă p < 0,05, p < 0,01 și p < 0,001 în comparație cu Sed după testul Kruskal-Wallis urmat de testul post hoc Dunn. Dimensiunile eșantioanelor (neuroni/șoareci): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) și 15/3 (Run3m). Barele orizontale denotă media ± SEM. Cercurile deschise corespund neuronilor de exemplu.

Figura 3. Efecte persistente ale exercițiului fizic cronic. (A) Design experimental. Injectarea RV-GFP a fost urmată de 3 săptămâni de alergare (Run1m) sau precedată de 1 lună de exerciții fizice (Run-1m) sau de 1 lună de exerciții fizice și 1 lună fără roata de alergare (Run-2m). Toate grupurile au fost comparate cu șoareci sedentari (Sed). Lungimea dendritică totală a fost analizată la 21 dpi. (B) Imagini confocale reprezentative ale GC-urilor marcate. Bară de scară, 50 μm. (C) Complexitatea dendritică (lungime și puncte de ramificare) pentru diferitele ferestre de funcționare. ∗∗∗∗ denotă p < 0,001 în comparație cu Sed după testul Kruskal-Wallis urmat de testul post hoc Dunn. Dimensiunile eșantioanelor (neuroni/șoareci): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) și 18/3 (Run-2m). (D) Morfologia MFB în CA3 a fost analizată pentru grupurile Run1m și Run-1m și comparată cu Sed. Imagini confocale reprezentative. Bară de scară, 5 μm. (E) ∗ și ∗∗ denotă p < 0,05 și p < 0,01 după testul Kruskal-Wallis urmat de testul post hoc Dunn. Dimensiunile eșantioanelor: 27/4 (Sed), 32/4 (Run1m) și 18/4 (Run-1m). Barele orizontale denotă media ± SEM. Cercurile deschise corespund butoanelor de exemplu.
Immunofluorescență
Imunocolorația a fost efectuată pe secțiuni coronale de 60-μm cu flotare liberă. Anticorpii au fost aplicați în soluție salină tamponată cu tris (TBS) cu 3% ser de măgar și 0,25% Triton X-100. Imunofluorescența a fost realizată folosind anticorpi anti GFP (policlonal de iepure; 1:500; Invitrogen), anti NeuN (monoclonal de șoarece; 1:50; un cadou de la F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Statele Unite), anticorpi de măgăriță anti-rabie Cy3 și de măgăriță anti-mouse Cy5 (1:250; Jackson Immuno Research Laboratories).
Microscopie confocală
Pentru măsurătorile lungimii dendritice, imaginile au fost achiziționate (40×; NA 1,3; imersie în ulei) din secțiuni groase de 60-μm, luând stive Z care includ 35-50 de felii optice, unitate aeriană = 1 la intervale de 0,8-μm (Trinchero et al, 2017). Lungimea dendritică a fost apoi măsurată cu ajutorul software-ului LSM Image Browser din proiecțiile reconstrucțiilor tridimensionale pe un singur plan în GCs care exprimă GFP. Imaginile MFB marcate cu GFP în regiunea CA3 au fost achiziționate la intervale de 0,4μm (63×; NA 1,4; imersie în ulei) și un zoom digital de 6. Suprafața și numărul de filopode au fost analizate din proiecții ale reconstrucțiilor tridimensionale pe un singur plan. Pentru cuantificare au fost selectate butoanele de fibre musculoase (MFB) care se potrivesc următoarelor criterii: (i) diametrul butonului a fost >de trei ori mai mare decât diametrul fibrei, (ii) butonul a fost conectat la fibra musculoasă la cel puțin un capăt (Toni et al., 2008). Filopodiile au fost identificate ca proeminențe care apar din terminale musculoase mari (1 μm < lungime < 20 μm) (Acsady et al., 1998). Extensiile filopodiale au fost măsurate prin numărarea numărului de proeminențe per terminal. Pentru capturarea imaginilor și analiza proprietăților morfologice, toate grupurile experimentale studiate au fost orbite de operator.
Analiză statistică
Dacă nu se specifică altfel, datele sunt prezentate ca medie ± SEM. Normalitatea a fost evaluată cu ajutorul testului Shapiro-Wilks, al testului omnibus D’Agostino-Pearson și al testului Kolmogorov-Smirnov, cu o valoare p de 0,05. În cazul în care datele au îndeplinit testele de normalitate (distribuție gaussiană și varianță egală), au fost utilizate, după cum este indicat, testul t nepereche cu corecția Welch sau ANOVA cu testul post-hoc al lui Bonferroni. În cazurile care nu au respectat normalitatea, au fost utilizate teste neparametrice, după cum urmează: Testul lui Mann-Whitney pentru comparații independente și testul Kruskal-Wallis pentru comparații multiple.
Rezultate
Am arătat anterior că alergarea accelerează dezvoltarea și integrarea funcțională a noilor GC în hipocampul îmbătrânit (Trinchero și colab., 2017). Am investigat acum dacă acest tip de plasticitate necesită un nivel persistent de activitate care se acumulează în timp sau dacă perioade mai scurte de alergare pot declanșa, de asemenea, o integrare mai rapidă, așa cum s-a observat anterior pentru expunerea la EE (Trinchero et al., 2019). Pentru a aborda această întrebare, noi cohorte neuronale au fost etichetate la șoareci de vârstă mijlocie (8 luni de vârstă; 8M) folosind un retrovirus care exprimă GFP (RV-GFP). Șoarecilor li s-a permis să folosească o roată de alergare timp de 1 săptămână în cadrul diferitelor ferestre de dezvoltare neuronală sau să alerge pentru întregul interval de creștere neuronală (3 săptămâni; Figurile 1A,B). După cum s-a descris anterior, noile GC au prezentat o dezvoltare lentă la șoarecii sedentari, ceea ce a dus la dendrite scurte cu ramificații mici la 3 săptămâni. Alergarea de o săptămână nu a schimbat aspectul general al noilor GC în niciunul dintre intervalele testate (figurile 1C,D). În schimb, alergarea pentru întregul interval de 3 săptămâni a dus la creșterea lungimii dendritelor și a ramificațiilor, în concordanță cu o integrare neuronală accelerată.
Efectele observate ale exercițiului fizic au fost testate pe o singură cohortă neuronală, cea care a fost marcată retroviral. Cu toate acestea, deoarece se generează continuu noi GC, este de conceput că GC născute în momente diferite în cadrul perioadei de exerciții ar putea fi, de asemenea, influențate de activitate. Pentru a testa această ipoteză, am folosit o strategie simplă de etichetare a cohortelor neuronale născute în momente diferite în ceea ce privește inițierea exercițiilor fizice, expunând șoarecii la roți de alergare pentru diferite intervale, dar analizând întotdeauna structura neuronală la 3 săptămâni după injectarea retrovirală (denumită 1m pentru simplitate). Astfel, au fost comparate trei cohorte; una care a alergat timp de 3 săptămâni, etichetată chiar la începutul exercițiului (Run1m), una care a alergat timp de 2 luni, etichetată la 1 lună după începerea exercițiului (Run2m), și una care a alergat 3 luni, etichetată la 2 luni după începerea exercițiului (Run3m) (Figura 2A) (Figura 2A). Am observat un grad similar de creștere neuronală în toate condițiile în comparație cu șoarecii sedentari, ceea ce indică faptul că toate cohortele neuronale născute în creierul unui șoarece de vârstă mijlocie care efectuează alergare voluntară vor suferi o creștere și o integrare rapidă (figurile 2B,C). Arborii dendritici ai GC-urilor de la șoarecii Run3m au fost ușor mai lungi decât cei de la șoarecii Run1m sau Run2m, sugerând că promovarea integrării neuronale ar putea răspunde unui mecanism al cărui efect se acumulează în timp. Cu toate acestea, 1 lună de alergare a dus la un efect aproape maxim asupra dezvoltării GC.
Am investigat apoi efectele exercițiilor fizice în creierul îmbătrânit asupra cohortelor neuronale născute odată ce activitatea s-a încheiat. Am comparat modul în care alergarea timp de 3-4 săptămâni influențează dezvoltarea de noi GC născute chiar la început (Run1m), la sfârșit (Run-1m) sau la 1 lună după terminarea exercițiului (Run-2m; Figura 3A). În mod surprinzător, cohortele neuronale născute la începutul sau la sfârșitul perioadei de alergare au răspuns în mod similar (figurile 3B,C). În schimb, cohortele născute la 1 lună după terminarea exercițiului (Run-2m) au prezentat doar un efect subtil.
Pentru a se integra pe deplin în circuit, GC-urile stabilesc conexiuni excitatorii glutamatergice pe celulele piramidale CA3 prin intermediul unor MFB-uri mari și recrutează inhibiția feedforward GABAergică pe celulele piramidale prin intermediul extensiilor filopodiale care apar din aceste terminale (Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). În timp ce analiza confocală nu a evidențiat modificări în zona MFB a neuronilor născuți la Run-1m sau Run1m în comparație cu controalele, numărul de filopode/MFB a crescut cu ∼100% (figurile 3D,E). Aceste rezultate indică faptul că exercițiul fizic crește în mod specific conectivitatea de la noile GC-uri pe rețeaua locală inhibitorie (Trinchero et al., 2019).
Discuție
Nurogeneza adultă implică o secvență de etape complexe de dezvoltare care are ca rezultat integrarea de noi unități de procesare a informațiilor. Celulele stem neuronale din zona subgranulară își părăsesc starea quiescentă pentru a deveni celule progenitoare neuronale proliferante care extind populația de precursori (celule amplificatoare de tranzit) (Bonaguidi et al., 2012). Celulele progenitoare generează neuroni care migrează, se dezvoltă și se integrează în circuit. În timpul acestei ferestre de timp extinse, există o reducere accentuată a rezervei neuronale din cauza morții celulelor apoptotice. Exercițiile fizice voluntare și EE constituie stimuli puternici pentru stimularea neurogenezei hipocampale adulte la rozătoare pe tot parcursul vieții (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Neurogeneza scade în creierul îmbătrânit, în principal ca o consecință a reducerii dimensiunii rezervei de celule progenitoare. Atât alergarea, cât și EE pot contracara scăderea producției neuronale raportate la animalele îmbătrânite, acționând prin mecanisme diferite (Kempermann et al., 2010). Alergarea acționează la două niveluri pentru a spori neurogeneza: creșterea ratei de proliferare a celulelor progenitoare neuronale (van Praag et al., 1999b, 2005; Cooper et al., 2018) și accelerarea maturizării și integrării funcționale a neuronilor în curs de dezvoltare (Trinchero et al., 2017). EE crește supraviețuirea și, de asemenea, accelerează maturarea noilor GC, dar nu influențează proliferarea (Trinchero et al., 2017, 2019).
Running promovează, de asemenea, recablarea conectivității neuronale și modularea proprietăților intrinseci în noile GC în timpul primei săptămâni de dezvoltare la șoarecii tineri-adulți (Sah et al., 2017). Am raportat recent o perioadă critică în timpul celei de-a doua săptămâni de maturare a GCs la animalele îmbătrânite, în care EE induce creșterea dendritică și integrarea mai rapidă a noilor neuroni în circuit (Trinchero et al., 2019). Am întrebat aici dacă rularea timp de 1 săptămână în orice moment al dezvoltării GCs ar afecta integrarea lor, dar nu am găsit niciun efect (Figura 1). Întreaga perioadă de alergare de 3 săptămâni a fost necesară pentru a regla neurogeneza. Lipsa unei modulații pe termen scurt sugerează un mecanism mediat de factori care trebuie să se acumuleze pentru a exercita schimbări notabile. În mod interesant, exercițiile fizice voluntare exacerbează producția de BDNF, care se acumulează pe parcursul săptămânilor înainte de a ajunge la un nivel de platou care exercită acțiuni maxime (Vecchio et al., 2018). Chiar dacă neurotrofinele sunt mediatori-cheie, este plauzibil ca efectele observate aici să fie mediate de mai multe mecanisme. Exercițiul stimulează, de asemenea, activitatea electrică în girusul dentat, crește fluxul sanguin și modulează neuroinflamarea (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). Contribuția altor mecanisme necesită studii suplimentare.
Demonstrăm aici că GC-urile de ∼3 săptămâni de la șoarecii îmbătrâniți expuși cronic la o roată de alergare (până la 3 luni) prezintă un fenotip complet dezvoltat cu arborizări dendritice lungi și complexe, similare cu cele ale noilor GC-uri generate la șoarecii adulți tineri (Figura 2). GC maturi la șoarecii tineri-adulți și la șoarecii de vârstă mijlocie ating o lungime și o complexitate dendritică echivalente până la sfârșitul dezvoltării, comparabile cu GC de 3 săptămâni la șoarecii îmbătrâniți expuși la EE sau la alergare (Piatti et al., 2011; Trinchero et al., 2017, 2019). Aceste dovezi acumulate vorbesc despre o accelerare clară a vitezei de maturizare evocată de alergare.
La nivelul producției neuronale, alergarea a promovat creșterea rapidă a extensiilor filopodiale, dar nu a modificat dimensiunea MBF-urilor (figurile 3D, E). Acest rezultat sugerează că noile CG se integrează rapid, dar ieșirea lor ar putea fi orientată spre activarea interneuronilor GABAergici din CA3 (contactați de filopode), mai degrabă decât a celulelor piramidale contactate de MFB (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Este surprinzător faptul că EE a provocat o creștere marcantă atât a dimensiunii MFB-urilor, cât și a numărului de extensii filopodiale la șoarecii îmbătrâniți, în concordanță cu o modulare mai echilibrată a producției neuronale (Trinchero et al., 2019). Noi speculăm că schimbările datorate EE implică remodelarea dependentă de activitate a sinapselor specifice care devin întărite pentru codificarea indicilor spațiale (Nicoll și Schmitz, 2005; Holtmaat și Svoboda, 2009). În schimb, alergarea poate reprezenta un stimulent general pentru ca noile CG să devină pregătite să se conecteze la ținte specifice atunci când codificarea devine necesară, păstrând în același timp tonusul inhibitor de la interneuronii GABAergici care ar putea acționa ca un mecanism de limitare a activității postsinaptice până când noua CG a fost asamblată corespunzător în cadrul rețelei înconjurătoare.
Rezultatele noastre indică faptul că creierul îmbătrânit generează semnale neurogenice atunci când șoarecii continuă să alerge pentru perioade prelungite (luni). În acest context, cohortele neuronale ulterioare născute la șoarecii care aleargă se vor dezvolta și integra rapid, permițând circuitelor de îmbătrânire să acumuleze un număr substanțial de neuroni noi (figura 4). Încorporarea continuă de noi GC cu caracteristici care se aseamănă cu ceea ce se întâmplă la șoarecii mai tineri are ca rezultat un hipocampus întinerit, cu neuroni care ar putea fi pregătiți să răspundă la experiențe viitoare.
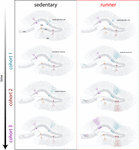
Figura 4. Reîntinerirea indusă de alergare a rețelei hipocampale la șoarecii de vârstă mijlocie. Reprezentare schematică a evoluției în timp a integrării neuronale la șoarecii sedentari (stânga) și la cei care aleargă (dreapta) după intervale prelungite de exerciții fizice voluntare. În zona subgranulară a girusului dentat, celulele de tip radial-glia (RGL) rămân într-o stare quiescentă (sus). Șoarecii sedentari care îmbătrânesc prezintă rate scăzute de neurogeneză și noii neuroni se dezvoltă într-un mod lent (cohortele reprezentative sunt indicate cu culori diferite). La șoarecii care aleargă, producția de noi GC este stimulată, iar aceste noi unități se dezvoltă și se integrează mai rapid, extinzând rețeaua neuronală într-o manieră cumulativă pe o perioadă de timp extinsă. În cele din urmă, aceste noi cohorte de neuroni complet maturi devin angajate pentru a procesa informații la cerere.
Dintr-o perspectivă mai largă, creșterea longevității asociată societății moderne este însoțită de un risc mai mare de declin cognitiv. Astfel, devine relevantă înțelegerea mecanismelor care stau la baza bine-cunoscutelor beneficii ale exercițiilor fizice asupra funcției cerebrale. În plus, ar putea exista diferențe pe termen lung între persoanele care practică exerciții fizice în diferite intervale de timp în viață și cele care au efectuat exerciții fizice în mod continuu, în ceea ce privește diminuarea riscului de a dezvolta boli neurodegenerative (Llorens-Martin, 2018). Rezultatele noastre demonstrează că alergarea continuă promovează integrarea mai multor cohorte neuronale, ridicând astfel complexitatea rețelei într-un mod remarcabil. Proiectarea unor strategii diferite pentru creșterea eficacității integrării de noi neuroni în hipocampus ar putea servi drept un mecanism promițător de plasticitate pentru a ameliora în cele din urmă declinul cognitiv care apare în creierul sănătos și bolnav care îmbătrânește. În cele din urmă, disecarea mecanismelor care stau la baza diferitelor aspecte ale unei astfel de integrări și dezvoltări neuronale accelerate ne va învăța multe despre potențialul de plasticitate a rețelelor neuronale în creierul îmbătrânit.
Date disponibile
Datele care susțin concluziile acestui studiu sunt disponibile la autorul corespondent, la o cerere rezonabilă.
Declarație etică
Studiul pe animale a fost revizuit și aprobat de comitetul pentru utilizarea și îngrijirea animalelor de laborator al Institutului Leloir.
Contribuții ale autorilor
MT și MH au efectuat experimentele și au analizat datele. MT, MH și AS au conceput experimentele și au scris manuscrisul. AS a oferit sprijin financiar.
Finanțare
Această lucrare a fost susținută de Agenția Argentiniană pentru Promovarea Științei și Tehnologiei (Grant# PICT2015-3814), de Institutul Național de Tulburări Neurologice și Accident Vascular Cerebral și de Centrul Internațional Fogarty (Grant# R01NS103758) pentru AS, care este cercetător în cadrul Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT a fost susținută de o bursă CONICET.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Le mulțumim membrilor laboratorului AS pentru discuțiile pătrunzătoare.
Acsady, L., Kamondi, A., Sik, A., Freund, T., și Buzsaki, G. (1998). Celulele GABAergice sunt țintele post-sinaptice majore ale fibrelor mossy în hipocampul șobolanului. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Dovezi autoradiografice și histologice de neurogeneză hipocampală postnatală la șobolani. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., și Wulff, P. (2015). Hipocampul în îmbătrânire și boală: de la plasticitate la vulnerabilitate. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., și Song, H. (2012). O ipoteză unificatoare privind proprietățile celulelor stem neuronale de mamifere în hipocampul adult. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | Ref. Full Text | Google Scholar
Burke, S. N., și Barnes, C. A. (2006). Plasticitatea neuronală în creierul îmbătrânit. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., și Barnes, C. A. (2010). Sinapsele senescente și dinamica circuitului hipocampal. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | Full CrossRef Text | Google Scholar
Buzsaki, G., și Moser, E. I. (2013). Memoria, navigația și ritmul theta în sistemul hipocampal-entorhinal. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | Text integral | Google Scholar
Cooper, C., Moon, H. Y. Y., și van Praag, H. (2018). Pe fugă pentru plasticitatea hipocampală. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | Textul integral | Google Scholar
Duzel, E., van Praag, H., și Sendtner, M. (2016). Poate exercițiile fizice la bătrânețe să îmbunătățească memoria și funcția hipocampului? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | Full CrossRef Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogeneza în hipocampul uman adult. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., și Villeda, S. A. (2017). Mecanisme de îmbătrânire a hipocampului și potențialul de întinerire. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., și Toni, N. (2013). Neurogeneza hipocampală adultă se corelează invers cu microglia în condiții de alergare voluntară și îmbătrânire. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | Full Text | Google Scholar
Holtmaat, A., și Svoboda, K. (2009). Plasticitatea sinaptică structurală dependentă de experiență în creierul mamiferelor. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., J. M., Christie, B. R., et al. (2011). Alergarea reduce stresul și îmbunătățește geneza celulară la șoarecii îmbătrâniți. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). De ce și cum activitatea fizică promovează plasticitatea cerebrală indusă de experiență. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | Text integral | Google Scholar
Kempermann, G., Kuhn, H. G., și Gage, F. H. (1998). Neurogeneza indusă de experiență în gyrusul dentat senescent. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., și Kempermann, G. (2006). Exercițiul fizic previne declinul legat de vârstă în activitatea celulelor precursoare în gyrusul dentat de șoarece. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulațiile de celule proliferante din hipocampul adult răspund diferit la stimuli neurogeni fiziologici. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | Text integral | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., și Gage, F. H. (1996). Neurogeneza în girusul dentat al șobolanului adult: scăderea legată de vârstă a proliferării progenitorilor neuronali. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Exersarea noilor neuroni pentru a învinge boala Alzheimer. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., și van Praag, H. (2012). Alergarea de-a lungul vârstei mijlocii îmbunătățește funcția de memorie, neurogeneza hipocampală și nivelurile BDNF la șoarecii femele C57BL/6J. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Neurogeneza hipocampală nu este necesară pentru efectele comportamentale ale îmbogățirii mediului. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | Full CrossRef Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Neurogeneza hipocampală adultă este abundentă la subiecții sănătoși din punct de vedere neurologic și scade brusc la pacienții cu boala Alzheimer. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., și Schinder, A. F. (2008). Celulele granule nou-născute în gyrusul dentat îmbătrânit. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., și Schmitz, D. (2005). Plasticitatea sinaptică la sinapsele fibrelor musculoase hipocampale. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., și Kelly, A. M. (2009). Expunerea pe termen lung la banda de alergare protejează împotriva schimbărilor neurodegenerative legate de vârstă în hipocampul de șobolan. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | Textul integral | Google Scholar
Paxinos, G., și Franklin, K. B. J. (2001). The Mouse Brain in Stereotaxic Coordinates (Creierul de șoarece în coordonate stereotaxice). Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., și Schinder, A. F. (2011). Calendarul pentru maturizarea neuronală în hipocampul adult este modulat de activitatea rețelei locale. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | Cross Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., și Frankland, P. W. (2015). Dezvoltarea conectivității celulelor generate de adulți cu populațiile de celule excitatorii și inhibitorii în hipocampus. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., și van Praag, H. (2017). Alergarea reorganizează circuitele neuronilor hipocampali născuți adulți de o săptămână. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Rani, A., Foster, T. C., și Ormerod, B. K. (2013). Exercițiul zilnic îmbunătățește memoria, stimulează neurogeneza hipocampală și modulează citokinele imune și neuroimune la șobolanii îmbătrâniți. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | Full CrossRef Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Reconstrucția fără cusur a neuronilor intacți născuți la vârsta adultă prin imagistică serială end-block dezvăluie ghidarea axonală complexă și dezvoltarea în hipocampul adult. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neuronii născuți în girusul dentat adult formează sinapse funcționale cu celulele țintă. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | Refef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Plasticitate ridicată a noilor celule granule în hipocampul îmbătrânit. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., și Schinder, A. F. (2019). Plasticitatea structurală dependentă de experiență a neuronilor născuți de adulți în hipocampul îmbătrânit. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., și Gage, F. H. (1999a). Alergarea îmbunătățește neurogeneza, învățarea și potențarea pe termen lung la șoareci. Proc. Natl. acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., și Gage, F. H. (1999b). Alergarea crește proliferarea celulară și neurogeneza în gyrusul dentat de șoarece adult. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., și Gage, F. H. (2005). Exercițiul fizic îmbunătățește învățarea și neurogeneza hipocampală la șoarecii în vârstă. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., și Aubert, I. (2018). Efectele neuroprotectoare ale exercițiilor fizice: menținerea unui creier sănătos de-a lungul îmbătrânirii. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | Textul integral | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Exercițiul fizic îmbunătățește proliferarea celulelor stem neuronale și creșterea neuronilor și supraviețuirea celulelor progenitoare neuronale în gyrusul dentat al șoarecilor de vârstă mijlocie. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M. M., și Hen, R. (2015). Alergarea salvează un deficit de discriminare contextuală bazată pe frică la șoarecii în vârstă. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | Full CrossRef Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Îmbunătățirea memoriei indusă de alergare se corelează cu conservarea spinilor subțiri în zona hipocampală CA1 a șoarecilor bătrâni C57BL / 6. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.




