Informații despre bariu
Denumit după cuvântul grecesc barys pentru „greu”, bariul este un metal alcalino-pământean relativ dens și reactiv. Se găsește în mod natural doar atunci când este combinat cu alte elemente, iar compușii care conțin bariu au o gamă largă de utilizări; se găsesc în otrava de șobolani, agenți de ponderare în fluidele de foraj petrolier și lichidul alb folosit pentru a vizualiza intestinele într-un test de diagnosticare cu raze X numit clismă de bariu.
Doar câteva date
- Numărul atomic (numărul de protoni din nucleu): 56
- Simbolul atomic (pe tabelul periodic al elementelor):
: Ba
- Greutate atomică (masa medie a atomului): 137,327
- Densitate: 2,09 uncii pe centimetru cub (3.62 grame pe centimetru cub)
- Fază la temperatura camerei: solid
- Punct de topire: 1.341 grade Fahrenheit (727 grade Celsius)
- Punct de fierbere: 3.447 F (1.897 C)
- Numărul de izotopi naturali (atomi ai aceluiași element cu un număr diferit de neutroni): 7
- Cel mai comun izotop: Ba-138
Descoperirea bariului
Vincenzo Casciarolo, un alchimist italian din secolul al XVII-lea, a observat pentru prima dată bariul sub forma unor pietricele neobișnuite care străluceau ani de zile după ce erau expuse la căldură, potrivit Societății Regale de Chimie. El a numit aceste pietricele „pietre de Bologna”, după numele orașului său natal, dar ulterior s-a stabilit că acestea erau sulfat de bariu (BaSO4). La sfârșitul secolului al XVIII-lea, oxidul de bariu (BaO) și carbonatul de bariu (BaCO3) au fost descoperite de chimistul german Carl Scheele și, respectiv, de chimistul englez William Withering.
Bariul metalic pur nu a fost izolat și identificat decât în 1808 la Royal Institution din Londra. Chimistul și inventatorul proeminent Sir Humphry Davy a folosit electroliza pentru a separa bariul din sărurile de bariu topite, cum ar fi hidroxidul de bariu (Ba(OH)2). În timpul electrolizei, un curent electric trece prin substanța ionică pentru a separa ionii unul de celălalt. Deoarece sărurile de bariu erau topite, ionii de bariu s-au deplasat cu ușurință către recipientul cu electrod negativ, iar ceilalți ioni negativi s-au deplasat cu ușurință în direcția opusă către recipientul cu electrod pozitiv.
Surse de bariu
Bariul se găsește în natură numai în combinație cu alte elemente, din cauza nivelului său ridicat de reactivitate. Bariul se găsește cel mai frecvent combinat cu sulfatul și carbonatul, dar poate forma, de asemenea, compuși cu hidroxidul, clorura, nitratul, cloratul și alți ioni negativi. Aproximativ 0,05% din scoarța terestră este formată din bariu, ceea ce îl face al 17-lea cel mai abundent element din scoarță, potrivit lui Robert E. Krebs în cartea sa, „The History and Use of Our Earth’s Chemical Elements”: A Reference Guide” (Greenwood Publishing Group, 2006). Rezervele miniere din Regatul Unit, Italia, Republica Cehă, Statele Unite și Germania conțin peste 400 de milioane de tone de bariu, potrivit lui John Emsley în cartea sa, „Nature’s Building Blocks: An A-Z Guide to the Elements” (Oxford University Press, 1999).
Pentru a obține bariu elementar pur, acesta trebuie separat de alte elemente prezente în compușii de bariu care apar în mod natural. Bariul poate fi extras din clorura de bariu prin electroliză. De asemenea, bariul poate fi obținut prin reducerea oxidului de bariu cu ajutorul aluminiului sau siliciului într-un vid de înaltă temperatură și joasă presiune.
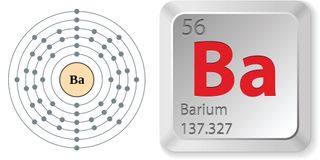
Proprietăți ale bariului
Bariul pur este un metal moale, alb-argintiu. Clasificat ca metal alcalino-pământos, se află în grupa, sau coloana 2 din tabelul periodic, alături de beriliu, magneziu, calciu, stronțiu și radiu. Fiecare dintre atomii lor conține doi electroni de valență (cei mai exteriori). Bariul se află în perioada, sau rândul, 5, astfel încât își păstrează electronii de valență în al cincilea înveliș și poate pierde electronii, sau se poate oxida, foarte ușor. Acest lucru explică nivelul ridicat de reactivitate al bariului, în special cu elemente electronegative precum oxigenul.
Utilizări comerciale ale bariului
Bariul elementar nu are multe utilizări practice, din nou din cauza nivelului său ridicat de reactivitate. Cu toate acestea, atracția sa puternică față de oxigen îl face util ca „getter” pentru a îndepărta ultimele urme de aer din tuburile cu vid. De asemenea, bariul pur poate fi combinat cu alte metale pentru a forma aliaje care sunt folosite la fabricarea unor elemente de mașini, cum ar fi rulmenții sau bujiile din motoarele cu combustie internă. Deoarece bariul are o reținere slabă a electronilor săi, aliajele sale emit cu ușurință electroni atunci când sunt încălzite și îmbunătățesc eficiența bujiilor, potrivit lui Krebs.
Compușii care conțin bariu au o varietate de utilizări comerciale. Sulfatul de bariu, sau baritul, este utilizat în litoponă (un pigment de strălucire în hârtia de imprimantă și în vopsele), în fluidele de foraj pentru puțuri de petrol, în fabricarea sticlei și în crearea cauciucului. Carbonatul de bariu este folosit ca otravă pentru șobolani, iar nitratul de bariu și cloratul de bariu produc culori verzi în focurile de artificii.
Bariul în organism
Un adult mediu conține aproximativ 22 mg de bariu, deoarece este prezent în alimente precum morcovii, ceapa, salata, fasolea și boabele de cereale. Nivelurile de bariu din dinți pot ajuta, de fapt, oamenii de știință să determine momentul în care bebelușii trec de la alăptare la consumul de alimente solide. Aceste niveluri scăzute de bariu nu au niciun rol biologic și nu sunt dăunătoare.
Cu toate acestea, cantitățile mari de săruri solubile de bariu pot fi toxice și chiar mortale, potrivit lui John Emsley în cartea sa „The Elements of Murder”: A History of Poison” (Oxford University Press, 2005). Bariul poate provoca vărsături, colici, diaree, tremurături și paralizie. Au existat câteva crime cu compuși de bariu, inclusiv uciderea în 1994 a unui bărbat din Mansfield, Texas, de către fiica sa de 16 ani, Marie Robards, care a furat acetat de bariu din laboratorul de chimie al liceului. De asemenea, mai mulți pacienți au fost uciși accidental de bariu atunci când s-a folosit din greșeală carbonat de bariu solubil în loc de sulfat de bariu insolubil în timpul unui test de diagnostic gastroenterologic (GI) numit clismă de bariu.
Medicii efectuează clisme cu bariu pentru a vizualiza și diagnostica anomalii ale intestinului gros și ale rectului, potrivit Johns Hopkins Medicine. În timpul procedurii, sulfatul de bariu este instilat prin rect pentru a acoperi pereții interiori ai intestinului gros. De obicei, se administrează apoi aer pentru a se asigura că stratul de bariu umple toate anomaliile de suprafață. Apoi, se utilizează raze X pentru a produce o imagine a tractului GI inferior. Sulfatul de bariu absoarbe razele X și apare alb pe filmul cu raze X, în contrast cu aerul și țesuturile din jur care apar negre. Analiza imaginii cu raze X de la clisma cu bariu le permite medicilor să diagnosticheze tulburări precum colita ulcerativă, boala Crohn, polipi, cancer și sindromul colonului iritabil.
.




