6.17: Fleratomiga joner
Vår diskussion om joniska föreningar var begränsad till monatomiska joner. Mer komplexa joner, som innehåller flera atomer som är kovalent bundna till varandra, men som har en positiv eller negativ laddning, förekommer dock ganska ofta i kemin. Laddningen uppstår eftersom det totala antalet valenceelektroner från atomerna inte kan ge en stabil struktur. Om en eller flera elektroner läggs till eller tas bort uppstår en stabil struktur. Välkända exempel på sådana polyatomära joner är sulfatjonen (SO42-),
hydroxidjonen (OH-),
hydroniumjonen (H3O+),
och ammoniumjonen (NH4+).
Atomer i dessa joner är förenade med varandra genom kovalenta elektronparbindningar, och vi kan rita Lewisstrukturer för jonerna precis som för molekyler. Den enda skillnaden är att antalet elektroner i jonen inte exakt balanserar summan av kärnladdningarna. Antingen finns det för många elektroner, och då har vi en anjon, eller för få, och då har vi en katjon.
Tänk till exempel på hydroxidjonen (OH-) för vilken Lewisstrukturen är
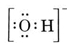
En neutral molekyl som innehåller en O-atom och en H-atom skulle bara innehålla sju elektroner, sex från O och en från H. Hydroxidjonen innehåller dock en oktett av elektroner, en mer än den neutrala molekylen. Hydroxidjonen måste därför bära en enda negativ laddning. För att kunna rita Lewisstrukturen för en viss jon måste vi först fastställa hur många valenceelektroner det rör sig om. Anta att vi behöver strukturen för H3O+. Det totala antalet elektroner fås genom att addera valenceelektronerna för varje atom, 6 + 1 + 1 + 1 + 1 = 9 elektroner. Vi måste nu subtrahera 1 elektron eftersom den aktuella arten inte är H3O utan H3O+. Det totala antalet elektroner är alltså 9 – 1 = 8. Eftersom detta är en oktett av elektroner kan vi placera dem runt O-atomen. Den slutliga strukturen följer då mycket enkelt:
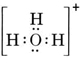
I mer komplicerade fall är det ofta användbart att beräkna antalet delade elektronpar innan man ritar en Lewisstruktur. Detta gäller särskilt när jonen i fråga är en oxyanjon (dvs. en central atom är omgiven av flera O-atomer). En välkänd oxyanjon är karbonatjonen, som har formeln CO32-. (Observera att centralatomen C skrivs först, på samma sätt som tidigare gjordes för molekyler). Det totala antalet valenceelektroner som finns tillgängliga i CO32- är
\( 4 \text{(för C)} + 3 \ gånger 6 \text{(för O)} + 2 \text{(för laddningen -2)} = 24 \)
Vi måste fördela dessa elektroner på 4 atomer, vilket ger varje atom en oktett, ett krav på 4 × 8 = 32 elektroner. Detta innebär att 32 – 24 = 8 elektroner måste räknas två gånger för oktettändamål, dvs. 8 elektroner delas. Ajonen innehåller alltså fyra elektronparbindningar. Förmodligen är C-atomen dubbelbunden till en av O-elektronerna och enkelbunden till de andra två:
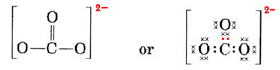
I detta diagram har de 4 C-elektronerna representerats med prickar, de 18 O-elektronerna med × och de 2 extraelektronerna med färgade prickar, för att underlätta hänvisningen. Verkliga elektroner har inte sådana etiketter; de är alla likadana.
Det finns en allvarlig invändning mot den Lewisstruktur som just ritats upp. Hur vet elektronerna vilken syreatom de ska välja ut och bilda en dubbelbindning med, eftersom det annars inte finns något som skiljer syreatomerna åt? Svaret är att de inte gör det. För att förklara bindningarna i CO32-jonen och vissa andra molekyler krävs en utvidgning av Lewis-teorin. Vi går vidare med denna fråga när vi diskuterar resonans. Nu avslutar vi med ett exempel.
Exempel \(\PageIndex{1}\) : Lewisstruktur
Rita en Lewisstruktur för sulfitjonen SO32-.
Lösning Den säkraste metoden här är att räkna elektroner. Det totala antalet tillgängliga valenselektroner är
6(för S) + 3 × 6(för O) + 2(för laddningen) = 26För att göra fyra oktetter för de fyra atomerna skulle det krävas 32 elektroner, och därför ger skillnaden, 32 – 26 = 6, antalet delade elektroner. Det finns alltså bara tre elektronparbindningar i jonen. Den centrala S-atomen måste vara kopplad med en enda bindning till varje O-atom.
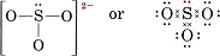
Bemärk att var och en av S-O-bindningarna är koordinatkovalent.
Medverkande
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff och Adam Hahn.




