CHEM 101 – Elektrolyter
ALLMÄNNA KEMISKA TÄMNINGAR
Elektrolyter
Dissociation av joniska föreningar i vatten resulterar i bildandet av rörliga vattenjoniska arter.Kemiska ekvationer för upplösning och dissociation i vatten. Starka och svaga elektrolyter.
Elektrolyter (musikaliskt ackompanjemang till detta ämne) är ämnen som skapar joniska arter i vattenlösning. Förekomsten av laddningsbärare i lösning kan påvisas med hjälp av ett enkelt experiment. Ledningsförmågan hos vattenhaltiga medier kan observeras med hjälp av ett par elektroder, anslutna till en spänningskälla, som är nedsänkta i lösningen. Den ström som lösningen då leder kan lätt mätas, och en glödlampa kan användas som en visuell indikator på en lösnings konduktivitet.
När detta experiment utförs med rent vatten lyser glödlampan inte alls. Vatten i sig leder inte lätt elektricitet; det är ett exempel på ett molekylärt ämne som är en icke-elektrolyt. Detta gäller för många andra molekylära ämnen. Bordsocker (sackaros, C12H22O11) är t.ex. ganska lättlösligt i vatten, men en sockerlösning leder tydligen inte elektricitet bättre än enbart vatten. När vi däremot utför experimentet med en lättlöslig jonisk förening som natriumklorid lyser glödlampan starkt.
Låt oss representera vad vi tror händer med dessa kontrasterande fall av upplösning av en molekylär och en jonisk förening genom att skriva följande kemiska ekvationer:
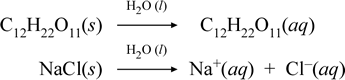
Den första ekvationen ovan representerar upplösningen av en icke-elektrolyt, den molekylära föreningen sackaros. Den andra ekvationen representerar upplösningen av en jonisk förening, natriumklorid.Den viktigaste skillnaden mellan de två kemiska ekvationerna i detta fall är att det i den senare bildas vattenjoniska arter som produkter. Jonerna är fria att diffundera individuellt i en homogen blandning, och när en spänning läggs på kommer jonerna att förflytta sig i enlighet med den elektriska potentialens energidifferens mellan elektroderna, och på så sätt transportera elektrisk ström. Observera att vatten inte visas på reaktantsidan i dessa ekvationer utan i stället visas ovanför pilen, vilket visar att vatten bestämmer den miljö där upplösningsprocessen sker. Vattnets superstoikiometriska status i denna symbolik kan tolkas som att en upplösningsprocess sker med vatten som lösningsmedel. Vi kommer inte att skriva vatten som en reaktant vid bildandet av en vattenlösning genom en enkel upplösningsprocess. Det finns många fall där ett ämne reagerar med vatten när det blandas med och löser sig i vatten. Denna reaktion av en lösta substans i vattenlösning ger upphov till kemiskt skilda produkter. I sådana fall kan vatten uttryckligen visas i den kemiska ekvationen som en reaktantart.
Starka och svaga elektrolyter
Det visar sig att när en löslig jonisk förening som t.ex. natriumklorid genomgår en upplösning i vatten för att bilda en vattenlösning som består av lösta joner, är den högerpilen som används i den kemiska ekvationen motiverad i och med att (så länge som löslighetsgränsen inte har uppnåtts) den fasta natriumklorid som tillsätts i lösningsvattnet helt dissocieras. Med andra ord sker i praktiken en 100-procentig omvandling av NaCl(s) till Na+(aq) och Cl-(aq). Som ett resultat av detta är en natriumkloridlösning i vårt konduktivitetsexperiment mycket konduktiv på grund av överflödet av joner, och glödlampan lyser starkt. I ett sådant fall säger vi att natriumklorid är en stark elektrolyt.
Den molekylära substansen ättiksyra, HC2H3O2.När ättiksyra löses upp i vatten bildar den en odissocierad, solvatiserad, molekylär artsymboliserad som HC2H3O2(aq), i likhet med fallet med sackaros ovan. När vi utför vårt konduktivitetstest med en ättiksyrelösning finner vi emellertid att glödlampan lyser, om än ganska svagt jämfört med den ljusstyrka som observerades för natriumkloridlösningen. I detta fall måste det åtminstone delvis bildas joner från ättiksyra i vatten. En kemisk ekvation som representerar denna process måste visa att joner bildas. Ett rimligt förslag till en sådan ekvation skulle vara:
![]()
Två saker är viktiga att notera här. För det första är detta ett fall där vi inkluderar vatten som reaktant. De två molekylära ämnena, vatten och ättiksyra, reagerar för att bilda de polyatomära jonerna hydronium och acetat. Ekvationen som representerar detta är en jonekvation. Den andra egenskapen som förtjänar att diskuteras närmare är att den högerriktade pilen har ersatts med symbolen för dubbla pilar med enkelbalk, som betecknar en kemisk jämvikt, och i detta fall gynnar jämviktsförhållandet för reaktionen reaktanterna, vilket innebär att i en vattenlösning av ättiksyra förblir det mesta av ättiksyran kvar i form av ättiksyramolekyler, och att endast en liten del av den vid varje tidpunkt har avgivit H+ till vatten för att bilda jonerna. Det lilla antalet joner som bildas förklarar varför ättiksyrolösningen inte leder elektricitet lika bra som natriumkloridlösningen, vilket resulterar i att glödlampan i vår konduktivitetsdetektor endast lyser svagt. Vi skiljer därför mellan starka elektrolyter, som natriumklorid, och ättiksyra, som är ett exempel på en svag elektrolyt.
Som namnet ättiksyra antyder är detta ämne också en syra samt en svag elektrolyt. Följaktligen klassificerar vi ättiksyra som en svag syra. Vår första (och minst allmänna) definition av en syra är ett ämne som skapar hydroniumjoner i vatten, vilket är precis vad vår jonekvation ovan visar, med tanke på att en svag syra skapar relativt små mängder hydroniumjoner.
Kemister är mycket förtjusta i förkortningar, och en viktig förkortning för hydroniumjonen är H+(aq), och detta är vanligt förekommande. Detta visas i den förkortade versionen av ovanstående ekvation som visas strax nedan. För att klargöra att H+ i sig självt bara skulle vara en isolerad proton (för 1H); därför är det också viktigt att notera att det inte finns någon sådan art i vattenlösning.
För övrigt har pilarna gjorts ojämnt långa för att indikera den reaktantfavoriserade jämvikten, där det finns mycket färre joner än ättiksyramolekyler.
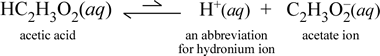
Då hydronium representeras som H+(aq) balanseras formellt den joniska ekvationen för ättiksyra i vatten utan att inkludera en vattenmolekyl som reaktant, vilket är underförstått i ovanstående ekvation.
Ammoniak: Ett exempel på en svag elektrolyt som är en svag bas
Ättiksyra är som vi just har sett en molekylär förening som är svag syra och elektrolyt. Ammoniak, NH3, en annan enkel molekylär förening, reagerar också i liten utsträckning med vatten och bildar ammonium- och hydroxidjoner. Vår första, minst allmänna definition av en bas är ett ämne som skapar hydroxidjoner i vatten. Ammoniak är alltså en svag bas, och i likhet med ättiksyra leder den inte elektricitet lika bra som ett vattenhaltigt salt. Ammoniak är alltså också en svag elektrolyt.
![]()
Symboliken i vår kemiska ekvation visar återigen på en reaktantfördelad jämvikt för den svaga elektrolyten.
Utvidgningar och kopplingar
Ett mer kvantitativt tillvägagångssätt för jämvikter använder sig av svaga syror och svaga basersom viktiga exempel.




