CHEM 245 – Enzymhämning
BIOKEMISTRISKA TÄMNINGAR
Enzymhämning
Typer av hämmare och hämning.Reversibla och irreversibla hämmare och hämning. Modeller för och kinetiska effekter av kompetitiv och icke-kompetitiv hämning. Blandad hämning.Exempel på enzymhämning.
Enzymernas specificitet är inte strikt begränsad till substrat. Ofta minskas aktiviteten hos ett enzym genom specifika interaktioner med molekyler som benämns hämmare. Enzymhämning är ett av de viktigaste fenomenen inom biokemin. Många läkemedel, antibiotika och toxiner utövar till exempel sina effekter genom sin förmåga att hämma ett enzym. Inhibitorer som strukturellt liknar substratet är ofta kompetitiva hämmare, eftersom de konkurrerar om att binda sig vid den aktiva platsen. Enzymhämning kan vara reversibel (vilket vanligtvis är fallet när en hämmare binder till enzymet via icke-kovalenta interaktioner) eller irreversibel (vilket sker i många fall där hämmare verkar via kovalenta modifieringar av enzymet, kanske genom att rikta in sig på en kritisk rest för katalysen).
Vi kan föreställa oss flera enkla modeller för reversibel hämning. Den enklaste av dessa är direkt ocklusion av den aktiva platsen av inhibitorn. Detta skulle ses i fallet med en molekyl med viss strukturell likhet med substratet. Bindning av substrat och hämmare är ömsesidigt uteslutande i denna modell för kompetitiv hämning.
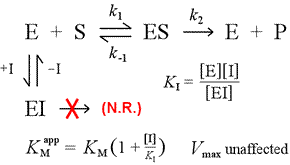
Till höger visas en enkel mekanistisk modell för kompetitiv hämning. Hämmaren, I, binder endast till det fria enzymet E, med en dissociationskonstant KI , och blockerar substratbindningen (S). Genom att binda en del av enzymet i det inaktiva EI-komplexet är mindre av enzymet tillgängligt vid en given substratkoncentration för att kombinera med substratet och bilda ES och sedan potentiellt omvandlas till produkter. En ökning av den tid som krävs för att nå ½Vmax kommer att observeras, vilket innebär att det skenbara värdet av KM ökar.
Om substratet ökar till allt högre nivåer kan substratet överväldiga inhibitorn och konkurrera ut den för det fria enzymet i en sådan utsträckning att den verkliga Vmax fortfarande kan närmas.
Vi kan lätt föreställa oss att en molekyl som liknar substratet i vissa viktiga strukturella egenskaper skulle kunna konkurrera med substratet om att binda den vid den aktiva platsen. Detta kallas en substratanalog, och de utgör vanliga exempel på kompetitiva hämmare av enzymer. Om enzymer ökar reaktionshastigheten genom att selektivt stabilisera övergångstillståndet i reaktionen, så om vi kan hitta en molekyl som liknar övergångstillståndet (i struktur och polaritet eller laddning) borde en sådan övergångstillståndsanalog vara en mycket bra kompetitiv hämmare.
Vi kommer att kontrastera modellen med kompetitiv hämning mot okompetitiv hämning, där hämmaren endast binder till enzym-substratkomplexet. Man kan tänka sig att detta sker som ett resultat av en enzym-substratinteraktion av typen induced-fit, där en bindningsplats för en hämmare endast finns tillgänglig i den inducerade konformationen av ES.
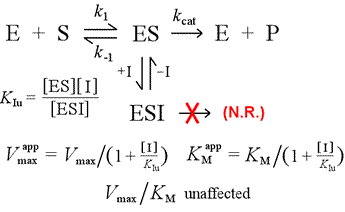
Vänster: En mekanistisk modell för okompetitiv hämning. I denna modell binder inhibitorn endast ES-komplexet och inte det fria enzymet. Det ternära komplexet, ESI, går inte vidare till produkter. Detta har till följd att den skenbara Vmax-gränsen sänks. Hämmarens dissociationskonstant för ESI betecknas KIu. I en effekt som förklaras av Le Châteliers princip är den skenbara KM lägre, eftersom inhibitorns bindning tar bort en del av produkten (ES) från ES-bildningens ”jämvikt”.
En modell för hämning där inhibitorn binder både fritt enzym och enzym-substratkomplexet är blandad hämning. Inhibitorens dissociationskonstant kan skilja sig mellan E och ES (dvs. KI ≠ KIu). Specialfallet där KI = KIu går under namnet icke-kompetitiv hämning. Observera att i detta fall påverkas inte KM, medan Vmax sänks.
Typer av reversibel enzymhämning – en sammanfattning
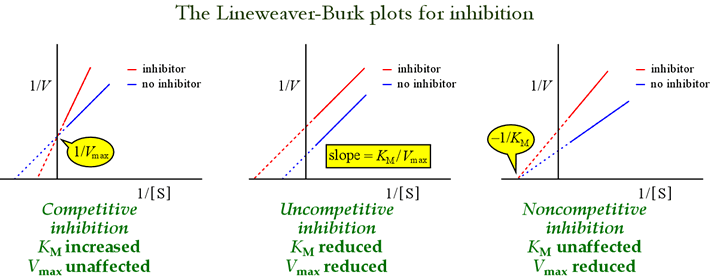
Vi har sett att de olika modellerna för reversibel hämning kan särskiljas efter effekter på kinetiska parametrar. I tabellen nedan sammanfattas typerna av hämning och deras effekter på dessa parametrar.

Lineweaver-Burk, eller dubbelt reciproka plottar är användbara för att identifiera hämmningsmönster. Figuren nedan visar hur olika typer av hämning påverkar plotten.
Exempel på enzymhämning
Det första och mest använda läkemedlet, acetylsalicylat (salicylat = orthohydroxibensoat), allmänt känt som aspirin, är ett effektivt analgetikum (smärtlindrande), antipyretikum (febernedsättande) och antiinflammatoriskt medel. De medicinska egenskaperna hos pilbark har varit kända i vissa kulturer i århundraden. På 1800-talet fann man att den aktiva ingrediensen var en kombination av salicylalkohol och salicylalkohol. På grundval av dessa och andra observationer samt framsteg inom kemisk syntes blev aspirin tillgängligt i mitten av århundradet efter att ha framställts av Hoffman, en kemist anställd av Bayer. Modernare undersökningar har fastställt att de medicinska egenskaperna hos aspirin till stor del härrör från dess förmåga att irreversibelt hämma ett enzym som kallas cyklooxygenas, vilket krävs för syntesen av prostaglandineroch tromboxaner.
Cyklooxygenaser katalyserar det första steget i omvandlingen av arakidonat till en föregångare till prostaglandiner och tromboxaner, prostaglandin G2 (PGG2, strukturer och reaktion). Reaktionen använder två molekyler O2 och omvandlar C20:4-fettsyran till en peroxiderad molekyl som innehåller en cyklopentanring (PGG2 – PG står för ”prostaglandin”). Cyklooxygenasenzymet har också en hydroperoxidasaktivitet som omvandlar PGG2 till PGH2. Därför skulle ”cyklooxygenas” (COX) mer korrekt betecknas som prostaglandin endoperoxid H-syntas (PGHS). Aspirins hämning av cyklooxygenasaktiviteten beror på dess förmåga att kemiskt modifiera en serinrest (Ser530) i enzymet. Serinresterna får en acetylgrupp från aspirin, en irreversibel modifiering. Aspirin är således ett exempel på en irreversibel hämmare. Det finns egentligen två COX-isoenzymer: en konstitutiv form, COX-1 (PGHS-1), och en inducerad form (under inflammationsförhållanden), COX-2 (PGHS-2). Icke-steroida antiinflammatoriska läkemedel (NSAID) som aspirin, ibuprofen och naproxen hämmar i allmänhet båda isoformerna. Följaktligen ger dessa läkemedel oönskade biverkningar, t.ex. gastrointestinal irritation. Ett aktuellt mål för den farmakologiska forskningen är därför att utveckla hämmare som är specifika för COX-2, en effekt som tros förmedla de flesta av de smärtstillande och antiinflammatoriska effekterna av NSAID-preparat.
Relaterade sidor:
- introduktion i kemisk kinetik
- introduktion i enzymologi
- enzymkinetik
- Michaelis-Menten-ekvation
.




