Definition av vågfunktion
Fundamentala partiklar, såsom elektroner, kan beskrivas som partiklar eller vågor.
Elektroner kan beskrivas med hjälp av en vågfunktion. vågfunktionens symbol är den grekiska bokstaven psi, Ψ eller ψ.

Vågfunktionen Ψ är ett matematiskt uttryck.Det bär viktig information om den elektron som det är förknippat med: från vågfunktionen får vi elektronens energi, vridmoment och orbitala orientering i form av kvanttalen n, l och ml.
Vågfunktionen kan ha ett positivt eller negativt tecken.Tecknet är viktigt vid beräkningar.Det är också viktigt när vågfunktionerna hos två eller flera atomer kombineras för att bilda en molekyl.
Vågfunktioner med likadana tecken (vågor i fas) interfererar konstruktivt, vilket leder till möjligheten till bindning.Vågfunktioner med olikadana tecken (vågor ur fas) interfererar destruktivt.
1926 härledde Erwin Schrödinger vågfunktionen för den enklaste av alla atomer, vätgas.Att lösa Schrödingerekvationen gör det möjligt för forskarna att bestämma vågfunktioner för elektroner i atomer och molekyler.
Schrödingerekvationen är en kvantmekanisk ekvation: beräknade vågfunktioner har diskreta, tillåtna värden för elektroner som är bundna i atomer och molekyler; alla andra värden är förbjudna.
Förutom Ψ:s betydelse har dess kvadrat Ψ2 också en enorm betydelse inom kemin.
Ψ2 är sannolikhetstätheten.Den talar om var elektronerna med störst sannolikhet befinner sig i utrymmet runt atomkärnan.
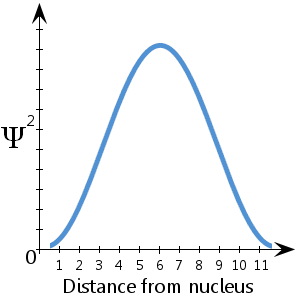
I det (fiktiva) schematiska diagrammet här, som visar Ψ2 mot avståndet från kärnan, ser vi till exempel att elektronen med största sannolikhet befinner sig mellan cirka 5-7 enheter från kärnan.Vi ser också att sannolikheten är försvinnande liten att elektronen befinner sig vid kärnan eller mer än cirka 11½ enheter från kärnan.
Det finns en 100-procentig sannolikhet att elektronen befinner sig någonstans – med andra ord en sannolikhet på 1.
Ψ kan beräknas exakt endast för atomer med en elektron, det vill säga H, He+, Li2+, Be3+, B4+, C5+ etc. På matematiskt språk säger vi att analytiska lösningar för Ψ endast är möjliga för system med en elektron. system med en elektron beskrivs ofta som vätebaserade – vilket betyder ”som väte”.”
För alla andra atomer, joner och molekyler är inga analytiska lösningar för Ψ möjliga;approximationsmetoder är nödvändiga för att beräkna den.
Ψ2 och hydrogeniska banor
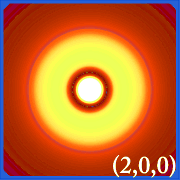
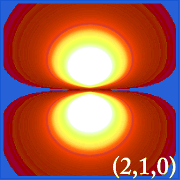
Plottning av vätets sannolikhetstäthet (i.dvs. Ψ2) för olika kvanttal gör det möjligt att visualisera det utrymme, centrerat på kärnan, som elektronerna upptar.De olika Ψ2-fördelningarna är vätgasens elektronorbitaler.Vilken orbital som faktiskt är upptagen bestäms av hur mycket energi elektronen har.
Exempel på vätens orbitaler