Kemi
Bildningen av en lösning är ett exempel på en spontan process, en process som sker under bestämda förhållanden utan krav på energi från någon extern källa. Ibland rör vi om i en blandning för att påskynda upplösningsprocessen, men detta är inte nödvändigt; en homogen lösning skulle bildas om vi väntade tillräckligt länge. Ämnet spontanitet är av avgörande betydelse för studiet av kemisk termodynamik och behandlas mer ingående i ett senare kapitel i den här texten. För diskussionen i det här kapitlet räcker det att beakta två kriterier som gynnar, men inte garanterar, att en lösning bildas spontant:
- en minskning av systemets inre energi (en exoterm förändring, som diskuterades i det föregående kapitlet om termokemi)
- en ökning av oordningen i systemet (vilket indikerar en ökning av systemets entropi, vilket du kommer att lära dig mer om i det senare kapitlet om termodynamik)
I upplösningsprocessen sker ofta, men inte alltid, en förändring av den inre energin i form av att värme tas upp eller utvecklas. En ökning av oordningen uppstår alltid när en lösning bildas.
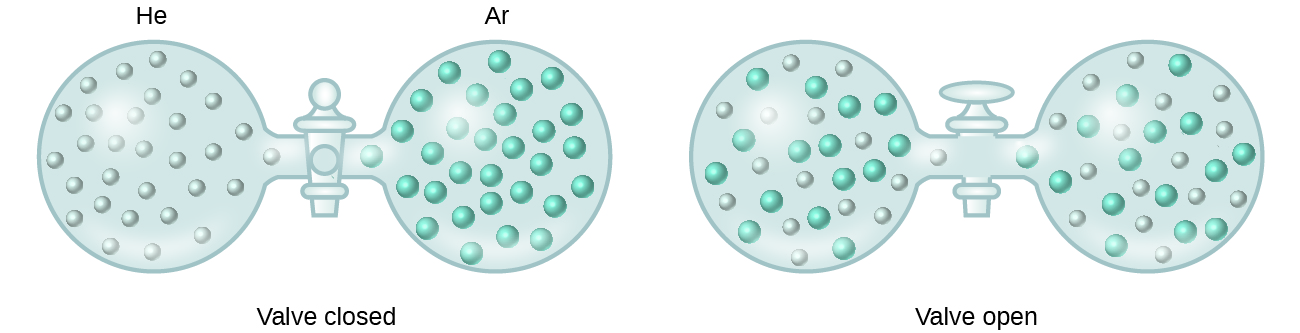
När styrkorna hos de intermolekylära attraktionskrafterna mellan lösta och lösningsmedelsarter i en lösning inte skiljer sig från de styrkor som finns i de separerade komponenterna bildas lösningen utan att någon åtföljande energiförändring sker. En sådan lösning kallas en idealisk lösning. En blandning av ideala gaser (eller gaser som helium och argon, som närmar sig idealt beteende) är ett exempel på en idealisk lösning, eftersom de enheter som består av dessa gaser inte upplever några betydande intermolekylära attraktioner.
När behållare med helium och argon kopplas samman, blandas gaserna spontant på grund av diffusion och bildar en lösning (figur 2). Bildandet av denna lösning innebär uppenbarligen en ökning av oordningen, eftersom helium- och argonatomerna upptar en volym som är dubbelt så stor som den som var och en av dem upptog innan de blandades.
Ideala lösningar kan också bildas när strukturellt liknande vätskor blandas. Exempelvis bildar blandningar av alkoholerna metanol (CH3OH) och etanol (C2H5OH) ideala lösningar, liksom blandningar av kolvätena pentan, C5H12, och hexan, C6H14. Om man placerar metanol och etanol, eller pentan och hexan, i de glödlampor som visas i figur 2 kommer det att resultera i samma diffusion och efterföljande blandning av dessa vätskor som observeras för gaserna He och Ar (även om det sker i en mycket långsammare takt), vilket ger lösningar utan någon betydande förändring av energin. Till skillnad från en blandning av gaser upplever dock komponenterna i dessa vätske-vätskelösningar verkligen intermolekylära attraktionskrafter. Men eftersom molekylerna i de två ämnen som blandas strukturellt sett är mycket lika, är de intermolekylära attraktionskrafterna mellan likadana och olikas molekyler i stort sett desamma, och upplösningsprocessen medför därför inte någon märkbar ökning eller minskning av energi. Dessa exempel illustrerar hur enbart diffusion kan utgöra den drivkraft som krävs för att orsaka den spontana bildningen av en lösning. I vissa fall kan dock de relativa storlekarna av intermolekylära attraktionskrafter mellan lösta och lösningsmedelsarter förhindra upplösning.
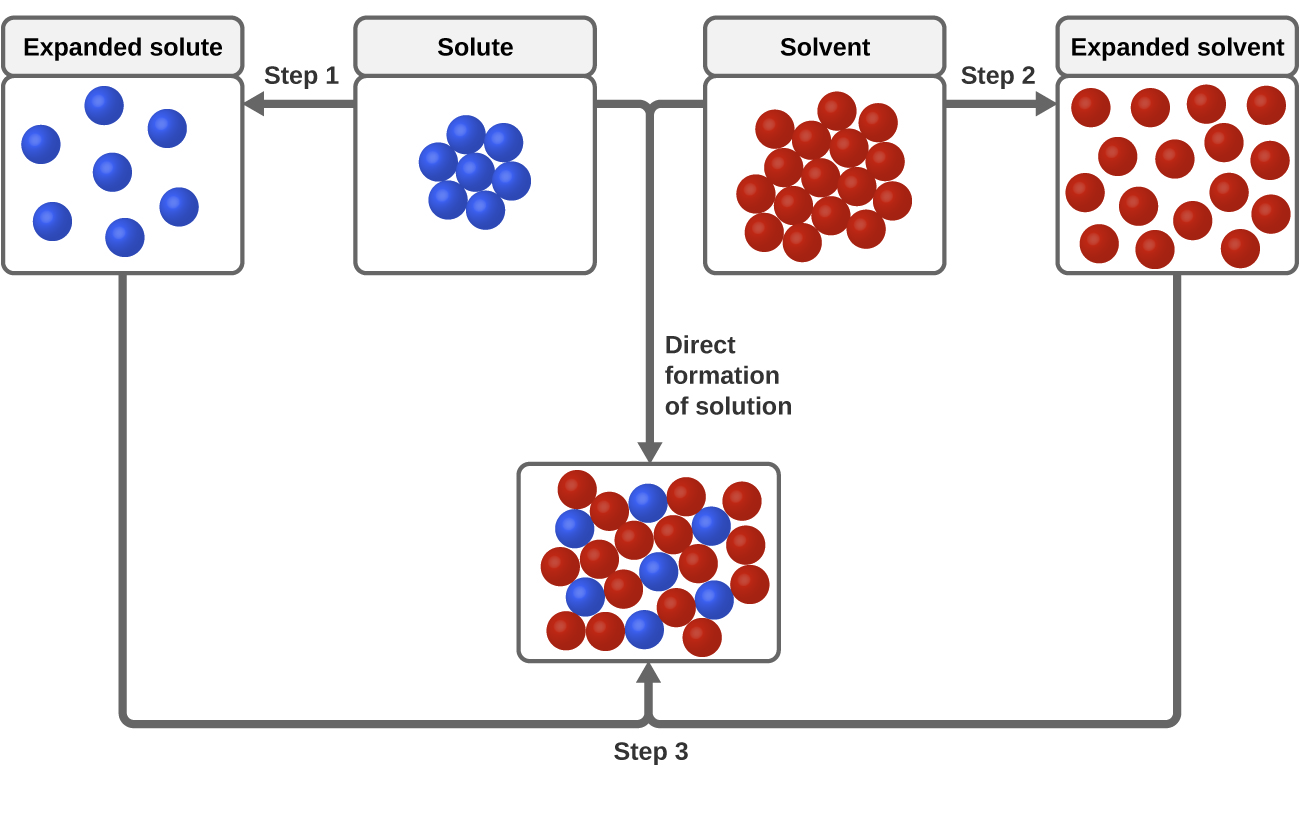
Tre typer av intermolekylära attraktionskrafter är relevanta för upplösningsprocessen: lösta-lösta, lösningsmedels-lösningsmedel och lösningsmedels-lösningsmedel. Som illustreras i figur 3 kan bildandet av en lösning ses som en stegvis process där energi förbrukas för att övervinna attraktionskrafter mellan lösningsmedel-löst och lösningsmedel-lösningsmedel (endoterma processer) och frigörs när attraktionskrafter mellan lösningsmedel-löstningsmedel etableras (en exoterm process som kallas solvation). Den relativa storleken på de energiförändringar som är förknippade med dessa stegvisa processer avgör om upplösningsprocessen som helhet kommer att frigöra eller absorbera energi. I vissa fall bildas inte lösningar eftersom den energi som krävs för att separera lösta och lösningsmedelsarter är så mycket större än den energi som frigörs genom solvation.
Smältoljor och vatten blandas till exempel inte i någon nämnvärd utsträckning för att ge lösningar (figur 4). Vätebindning är den dominerande intermolekylära attraktionskraften i flytande vatten. De opolära kolvätemolekylerna i matoljor kan inte vätebindas, utan hålls samman av dispersionskrafter. För att bilda en olja-vattenlösning måste man övervinna den mycket starka vätebindningen i vatten samt de betydligt starka dispersionskrafterna mellan de relativt stora oljemolekylerna. Och eftersom de polära vattenmolekylerna och de opolära oljemolekylerna inte skulle uppleva en mycket stark intermolekylär attraktion skulle mycket lite energi frigöras genom solvitation.

Å andra sidan kommer en blandning av etanol och vatten att blandas i alla proportioner för att ge en lösning. I det här fallet kan båda ämnena vätebinda, och därför är solvationsprocessen tillräckligt exotermisk för att kompensera för de endoterma separeringarna av lösningsmedels- och lösningsmedelsmolekylerna.
Som nämndes i början av den här modulen gynnas, men garanteras inte, den spontana lösningsbildningen av exoterma upplösningsprocesser. Medan många lösliga föreningar faktiskt löser sig med avgivande av värme, löser sig vissa endotermiskt. Ammoniumnitrat (NH4NO3) är ett sådant exempel och används för att göra omedelbara kylpaket för behandling av skador som den som visas i figur 5. En tunnväggig plastpåse med vatten är förseglad i en större påse med fast NH4NO3. När den mindre påsen bryts bildas en lösning av NH4NO3 som absorberar värme från omgivningen (det skadade området som packningen appliceras på) och ger en kall kompress som minskar svullnaden. Endoterma upplösningar som denna kräver en större energiåtgång för att separera de lösta arterna än vad som återvinns när de lösta ämnena solvatiseras, men de är ändå spontana på grund av den ökning av oordningen som åtföljer bildandet av lösningen.


Se den här korta videon som illustrerar endoterma och exoterma upplösningsprocesser.
Nyckelbegrepp och sammanfattning
En lösning bildas när två eller flera ämnen kombineras fysikaliskt för att ge en blandning som är homogen på molekylnivå. Lösningsmedlet är den mest koncentrerade komponenten och bestämmer lösningens fysiska tillstånd. Lösningsämnena är de andra komponenterna som vanligtvis finns i koncentrationer som är lägre än lösningsmedlets. Lösningar kan bildas endotermiskt eller exotermiskt, beroende på de relativa storlekarna av de intermolekylära attraktionskrafterna hos lösningsmedlet och lösningsmedlet. Ideala lösningar bildas utan någon märkbar förändring i energi.
Kemi övningar i slutet av kapitlet
- Hur skiljer sig lösningar från föreningar? Från andra blandningar?
- Vilka av de viktigaste egenskaperna hos lösningar kan vi se i de lösningar av K2Cr2O7 som visas i figur 1?
- När KNO3 löses upp i vatten är den resulterande lösningen betydligt kallare än vad vattnet ursprungligen var.
(a) Är upplösningen av KNO3 en endotermisk eller exotermisk process?
(b) Vilka slutsatser kan du dra om de intermolekylära attraktioner som är involverade i processen?
(c) Är den resulterande lösningen en idealisk lösning?
- Ge ett exempel på var och en av följande typer av lösningar:
(a) en gas i en vätska
(b) en gas i en gas
(c) ett fast ämne i ett fast ämne
- Ange de viktigaste typerna av intermolekylära attraktioner i var och en av följande lösningar:
(a) Lösningen i figur 1.
(b) NO(l) i CO(l)
(c) Cl2(g) i Br2(l)
(d) HCl(aq) i bensen C6H6(l)
(e) Metanol CH3OH(l) i H2O(l)
.
- Förutsäg om vart och ett av följande ämnen skulle vara mer lösligt i vatten (polärt lösningsmedel) eller i ett kolväte som heptan (C7H16, opolärt lösningsmedel):
(a) vegetabilisk olja (opolärt)
(b) isopropylalkohol (polärt)
(c) kaliumbromid (joniskt)
- Värme frigörs när vissa lösningar bildas; värme absorberas när andra lösningar bildas. Ge en molekylär förklaring till skillnaden mellan dessa två typer av spontana processer.
- Lösningar av väte i palladium kan bildas genom att Pd-metallen utsätts för H2-gas. Koncentrationen av väte i palladiumet beror på det tryck av H2-gas som appliceras, men på ett mer komplext sätt än vad som kan beskrivas med Henrys lag. Under vissa förhållanden löses 0,94 g vätgas upp i 215 g palladiummetall.
(a) Bestäm molariteten hos denna lösning (lösningens densitet = 1,8 g/cm3).
(b) Bestäm molaliteten för denna lösning (lösningens densitet = 1,8 g/cm3).
(c) Bestäm viktprocenten av väteatomer i denna lösning (lösningens densitet = 1,8 g/cm3).
.




