Natriumklorid, NaCl
Natriumkloridmolekylen är ett klassiskt fall av jonisk bindning och bildas genom jonisering av natrium- och kloratomer och attraktion av de resulterande jonerna.
En natriumatom har en 3s elektron utanför ett slutet skal, och det krävs endast 5,14 elektronvolt energi för att ta bort den elektronen. Kloret saknar en elektron för att fylla ett skal, och frigör 3,62 eV när det förvärvar den elektronen (dess elektronaffinitet är 3,62 eV) Detta innebär att det krävs endast 1,52 eV energi för att donera en av natriumelektronerna till kloret när de är långt ifrån varandra. När de resulterande jonerna förs närmare varandra blir deras elektriska potentiella energi mer och mer negativ och når -1,52 eV vid cirka 0,94 nm avstånd. Detta innebär att om neutrala natrium- och kloratomer befann sig närmare varandra än 0,94 nm skulle det vara energimässigt gynnsamt att överföra en elektron från Na till Cl och bilda jonbindningen.
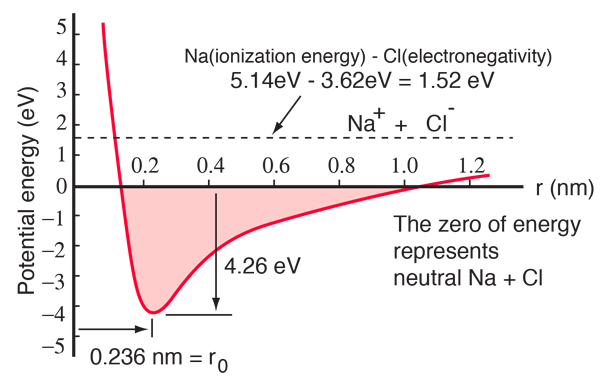
Potentialenergikurvan visar att det finns ett minimum vid 0,236 nm separation och sedan en brant ökning av potentialen som representerar en repulsiv kraft. Denna repulsiva kraft är mer än bara en elektrostatisk repulsion mellan de två atomernas elektronmoln. Den har en kvantmekanisk karaktär som har sina rötter i Paulis uteslutningsprincip och kallas ofta bara för ”uteslutningsprincipens repulsion”. När jonerna är långt ifrån varandra överlappar inte vågfunktionerna för deras kärnelektroner varandra nämnvärt och de kan ha identiska kvantnummer. När de närmar sig varandra leder den ökande överlappningen av vågfunktionerna till att vissa av dem tvingas in i tillstånd med högre energi. Inga två elektroner kan inta samma tillstånd, så när en ny uppsättning energitillstånd bildas för det sammansatta systemet med två kärnor fylls de lägre energitillstånden och en del av elektronerna tvingas in i högre tillstånd. Detta kräver energi och upplevs som en repulsion, vilket hindrar jonerna från att komma närmare varandra.
Potentialdiagrammet ovan gäller för gasformigt NaCl, och miljön är annorlunda i det normala fasta tillståndet där natriumklorid (vanligt bordssalt) bildar kubiska kristaller. Jonseparationen är 0,28 nm, något större än i gasformigt tillstånd.
En stor del av studiet av molekylstruktur är beskrivningen av de kemiska bindningar som bildas mellan atomer. De klassiska studierna är de extrema joniska bindningarna i natriumklorid och de kovalenta bindningarna i vätemolekylen.
| Kemiska bindningar | Pauli-avstötning i joniska bindningar |
Bindningsenergi exempel




