Vad är skillnaden mellan joniska och kovalenta bindningar
Alla materia runt omkring dig hålls samman av kemiska bindningar. Ibland bryts kemiska bindningar, till exempel under en kemisk reaktion, bara för att atomerna ska binda sig igen och bilda olika molekyler. Energi frigörs alltid för att skapa bindningar och på samma sätt krävs det alltid energi för att bryta bindningar.
Det finns två huvudtyper av kemiska bindningar: joniska och kovalenta.
Vad är joniska och kovalenta bindningar?
Atomer binder sig till varandra för att bilda föreningar, eftersom de på så sätt uppnår lägre energier än vad de har som enskilda atomer, och blir stabilare i processen. När en ny kemisk bindning bildas frigör den kemiska reaktionen enligt lagen om bevarande av energi en energimängd (vanligen i form av värme) som är nästan lika stor som skillnaden i mängden lagrad kemisk energi mellan produkterna och reaktanterna. Denna lagrade kemiska energi i systemet, eller värmeinnehållet, kallas dess entalpi.
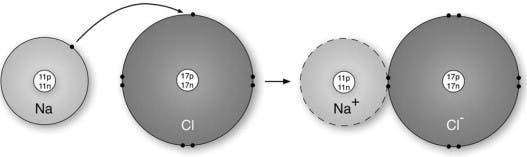
En jonisk bindning bildas när två joner med motsatt laddning utbyter elektroner mellan sig, där en jon är en atom som antingen har förlorat eller fått en elektron. Joner som förlorar en eller flera elektroner har fler protoner än elektroner, vilket innebär att de har en positiv laddning. Sådana joner kallas katjoner (metaller). Å andra sidan ger en jon som vinner elektroner en negativ laddning. Kemister kallar sådana joner för anjoner (icke-metaller).
Joniska föreningar är vanligtvis neutrala. Därför kombineras joner på ett sätt som neutraliserar deras laddningar.
Ett skolexempel på en jonisk förening är natriumklorid, även känt som bordssalt. En enskild natriumatom har 11 protoner och 11 elektroner, men bara en enda elektron i sitt yttre skal (eller valensskal). Klor består av 17 protoner och 17 elektroner och har 7 elektroner i sitt yttre skal. När de två atomerna reagerar förlorar natrium (elektropositivt) sin valenselektron till klor (elektronegativt). I den resulterande kristallstrukturen är varje natriumjon omgiven av sex kloridjoner och varje kloridjon är omgiven av sex natriumjoner. Dessutom har varje jon ett komplett elektronskal som motsvarar den närmaste inerta gasen; neon för en natriumjon, argon för en kloridjon
Kovalenta bindningar bildas när atomer eller joner delar elektroner på ett sådant sätt att deras yttre skal blir ockuperade. Kovalenta bindningar, även kallade molekylbindningar, bildas endast mellan icke-metalliska atomer med identiskt eller relativt nära elektronegativitetsvärde. Elektronegativitet, som betecknas med symbolen χ, är en kemisk egenskap som beskriver en atoms tendens att attrahera ett delat elektronpar (eller elektrontäthet) mot sig själv.
Antalet kovalenta bindningar som en atom kan bilda kallas för atomens valens. Denna egenskap representerar de elektroner i en atom som kan delta i bildandet av kemiska bindningar med andra atomer. De är de elektroner som befinner sig längst bort från kärnan.
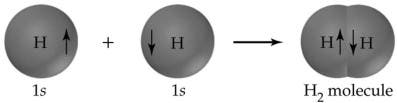
Ett utmärkt exempel på en kovalent bindning är vätemolekylen, som bildas av två väteatomer med varsin elektron i sitt yttre skal. Bindningsbildning frigör värme och är därför exotermisk. För vätemolekylen är den värme som frigörs under bildningen, även kallad standard entalpiändringen (ΔH°), -435 kJ per mol. Den omvända processen, att bryta H-H-bindningen, kräver 435 kJ per mol, en kvantitet som kallas bindningsstyrka.
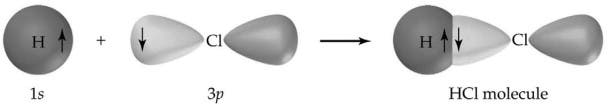
Ett annat klassiskt exempel på en kovalent bindning är vätgasklorid (HCl), som är en vätehalogenid. Kloratomen har 7 atomer i sitt yttre skal medan väte har 1 elektron i sitt yttre skal. Båda kombineras perfekt så att varje atom fyller sina valensskal och bildar en mycket stabil molekyl. Nu kommer HCl-molekylen inte att reagera vidare med andra klor- eller väteatomer.
Skillnader mellan joniska och kovalenta bindningar
- Kovalenta bindningar är mycket vanligare i organisk kemi än joniska bindningar.
- I kovalenta bindningar delar atomer på elektroner, medan atomer i joniska bindningar överför elektroner.
- Reaktionskomponenterna i kovalenta bindningar är elektriskt neutrala, medan de för joniska bindningar båda är laddade. Detta förklarar varför natriumklorid (salt) leder elektricitet när det löses upp – dess komponenter är laddade.
- Ioniska bindningar är mycket starkare än kovalenta bindningar.
- Kovalenta bindningar är mycket vanligare i naturen än joniska bindningar. De flesta molekyler i levande varelser är till exempel kovalent bundna.
- Kovalenta bindningar kan bildas mellan atomer av samma grundämnen (t.ex. H2). Joniska bindningar kan däremot inte göra detta.
- Kovalenta bindningar bildas mellan två icke-metaller, medan joniska bindningar bildas mellan en metall och en icke-metall.
- Molekyler som bildas med hjälp av kovalenta bindningar har en låg smältpunkt, medan molekyler med joniska bindningar har en hög smältpunkt. Samma förhållande gäller för kokpunkten.
- Vid rumstemperatur är molekyler med kovalenta bindningar i de allra flesta fall vätskor eller gaser, medan joniska föreningar är fasta.
Likheter mellan joniska och kovalenta bindningar
- Båda typerna av bindningar leder till att stabila kemiska föreningar bildas.
- Det krävs exoterma reaktioner (dvs. som avger värme) för att skapa joniska och kovalenta bindningar.
- Valenceelektroner är inblandade i båda bindningsprocesserna.
- Det spelar ingen roll om en molekyl bildas genom jonisk eller kovalent bindning när det gäller dess elektriska laddning: resultatet är alltid elektriskt neutralt.




