3.3: Partículas subatómicas – Electrones, protones y neutrones
Identificación y localización de las partículas subatómicas
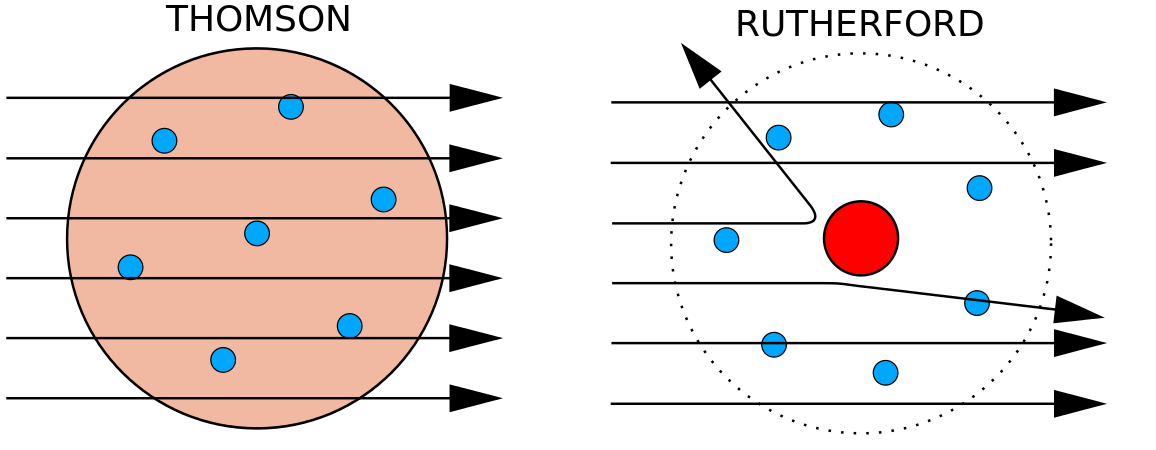
En 1897, el físico británico J. J. Thomson (1856-1940) demostró que los átomos no eran la forma más básica de la materia. Sus experimentos incluyeron el uso de tubos de rayos catódicos (TRC). En un entorno vacío, estos dispositivos producen rayos invisibles que se originan en un electrodo negativo (cátodo) y continúan hasta un electrodo positivo (ánodo). En estos experimentos, Thomson demostró que los rayos catódicos podían ser desviados, o doblados, por campos magnéticos o eléctricos, lo que indicaba que los rayos catódicos están formados por partículas cargadas . Y lo que es más importante, midiendo el grado de desviación de los rayos catódicos en campos magnéticos o eléctricos de distinta intensidad, Thomson pudo calcular la relación masa-carga de las partículas. Como las cargas similares se repelen y las opuestas se atraen, Thomson llegó a la conclusión de que las partículas tenían una carga neta negativa; estas partículas se llaman ahora electrones. Más relevante para el campo de la química, Thomson descubrió que la relación masa-carga de los rayos catódicos es independiente de la naturaleza de los electrodos metálicos o del gas, lo que sugería que los electrones eran componentes fundamentales de todos los átomos.
Durante la década de 1910, los experimentos con rayos X llevaron a esta útil conclusión: la magnitud de la carga positiva en el núcleo de cada átomo de un elemento particular es la misma. En otras palabras, todos los átomos del mismo elemento tienen el mismo número de protones. Además, los distintos elementos tienen un número diferente de protones en sus núcleos, por lo que el número de protones en el núcleo de un átomo es característico de un elemento concreto. Este descubrimiento fue tan importante para nuestra comprensión de los átomos que el número de protones en el núcleo de un átomo se denomina número atómico. Estos experimentos fueron realizados por Ernest Rutherford. A él se le atribuye la definición de un lugar central del átomo que ahora se ha denominado núcleo.
Rutherford era consciente de que los protones estaban dentro de esta región. Uno de los colegas de Ernest Rutherford, James Chadwick, realizó y estudió las reacciones radiactivas del berilio. Al golpear un núcleo de berilio con partículas alfa, se emitía una partícula de neutrón. En 1932, James Chadwick anunció la existencia de una tercera partícula subatómica, el neutrón. Esta partícula tiene una masa de 1 unidad de masa atómica, pero no tiene carga. Tras este descubrimiento, la ciencia y la tecnología nucleares se pusieron en marcha de inmediato.
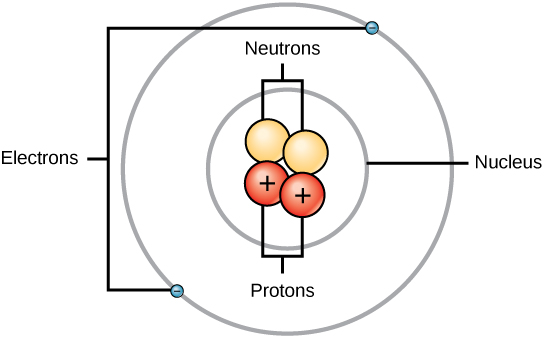
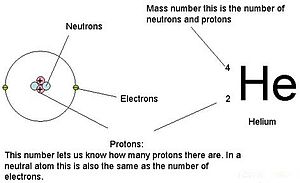
Las masas de las tres partículas subatómicas pueden expresarse en amu (unidades de masa atómica) o en gramos. Para simplificar, utilizaremos la unidad amu para las tres subatómicas. Tanto los neutrones como los protones tienen masas de 1 amu cada uno. En cambio, el electrón tiene una masa insignificante de 0,0005 amu. La masa de este subatómico no está representada en la masa decimal que aparece en la tabla periódica. Sólo los protones y los neutrones contribuyen al valor de la masa de un átomo.
es:User:Materialscientist)
Para los átomos (especies neutras), el número de electrones es equivalente al número de protones. Como resultado, todos los átomos tienen una carga global de cero. Para la discusión de los iones (átomos que ganan o pierden electrones), consulte la última parte de este capítulo. Los átomos que difieren en los valores de neutrones y masa de la tabla se llaman isótopos. Estas especies particulares se pueden ver en la siguiente sección del texto.
| Partícula subatómica | Símbolo | Carga relativa | Localización | Masa Amu |
|---|---|---|---|---|
| Protón | p | +1 | Dentro del núcleo | 1 |
| Neutrón | n | 0 | dentro del núcleo | 1 |
| Electrón | e- | -1 | fuera del núcleo | 0.0005 (~0) |
Ejemplo \(\PageIndex{1})
¿Cuál es la verdad?
- El núcleo contiene protones y electrones.
- La masa de un electrón está incluida en la masa del átomo
- Para un átomo, el número de protones = número de electrones.
Solución
- Falso, el núcleo contiene los protones y los neutrones. Los electrones están fuera del núcleo.
- Falso, los electrones no contribuyen al número de masa de un átomo.
- Verdadero, todos los átomos son neutros y deben tener el mismo número de protones que de electrones.




