CHEM 101 – Electrolitos
Temas de Química General
Electrolitos
La disociación de los compuestos iónicos en el agua da lugar a la formación de especies iónicas acuosas móviles.Ecuaciones químicas de disolución y disociación en el agua. Electrolitos fuertes y débiles.
Los electrolitos (acompañamiento musical de este tema) son sustancias que crean especies iónicas en solución acuosa. La existencia de portadores de carga en la solución puede demostrarse mediante un sencillo experimento. La conductividad de los medios acuosos puede observarse utilizando un par de electrodos, conectados a una fuente de tensión, que se sumergen en la solución. La corriente que conduce la solución puede entonces medirse fácilmente, y una bombilla puede utilizarse como indicador visual de la conductividad de una solución.
Cuando este experimento se realiza con agua pura, la bombilla no brilla en absoluto. El agua en sí no conduce la electricidad fácilmente; es un ejemplo de una sustancia molecular que es un no electrolito. Esto es cierto para muchas otras sustancias moleculares. Por ejemplo, el azúcar de mesa (sacarosa, C12H22O11) es bastante soluble en agua, pero una solución de azúcar aparentemente no conduce la electricidad mejor que el agua sola. En cambio, cuando realizamos el experimento con un compuesto iónico libremente soluble como el cloruro de sodio, la bombilla brilla intensamente.
Representemos lo que creemos que ocurre con estos casos contrastados de disolución de un compuesto molecular y uno iónico escribiendo las siguientes ecuaciones químicas:
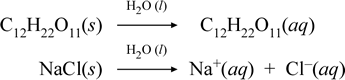
La primera ecuación anterior representa la disolución de un no electrolito, el compuesto molecular sacarosa. La segunda ecuación representa la disolución de un compuesto iónico, el cloruro de sodio.La distinción clave entre las dos ecuaciones químicas en este caso es la formación en la última de especies iónicas acuosas como productos. Los iones son libres de difundirse individualmente en una mezcla homogénea, y cuando se aplica un voltaje, los iones se moverán según la diferencia de energía potencial eléctrica entre los electrodos, transportando así la corriente eléctrica. Obsérvese que el agua no aparece en el lado del reactivo de estas ecuaciones, sino que se muestra encima de la flecha, lo que indica que el agua determina el entorno en el que se produce el proceso de disolución. El estado superestequiométrico del agua en esta simbología puede leerse como un proceso de disolución que ocurre con el agua como disolvente. No escribiremos el agua como reactivo en la formación de una solución acuosa por un simple proceso de disolución. Hay muchos casos en los que una sustancia reacciona con el agua al mezclarse y disolverse en ella. Esta reacción de un soluto en una solución acuosa da lugar a productos químicamente distintos. En estos casos, el agua puede mostrarse explícitamente en la ecuación química como especie reaccionante.
Electrolitos fuertes y débiles
Resulta que cuando un compuesto iónico soluble, como el cloruro de sodio, sufre una disolución en agua para formar una solución acuosa formada por iones solvatados, la flecha hacia la derecha utilizada en la ecuación química se justifica en que (mientras no se haya alcanzado el límite de solubilidad) el cloruro de sodio sólido añadido al agua solvente se disocia completamente. En otras palabras, efectivamente hay un 100% de conversión de NaCl(s) en Na+(aq) y Cl-(aq). Como resultado, en nuestro experimento de conductividad, una solución de cloruro de sodio es altamente conductiva debido a la abundancia de iones, y la bombilla brilla intensamente. En este caso, decimos que el cloruro de sodio es un electrolito fuerte.
En cambio, consideremos la sustancia molecular ácido acético, HC2H3O2.Cuando el ácido acético se disuelve en agua, forma una especie molecular no disociada y solvatada, simbolizada como HC2H3O2(aq), similar al caso de la sacarosa anterior. Sin embargo, cuando realizamos nuestra prueba de conductividad con una solución de ácido acético, encontramos que la bombilla brilla, aunque bastante débilmente en comparación con el brillo observado para la solución de cloruro de sodio. En este caso, debe haber al menos una formación parcial de iones de ácido acético en el agua. Una ecuación química que represente este proceso debe mostrar la producción de iones. Una propuesta razonable para tal ecuación sería:
![]()
Dos cosas son importantes de notar aquí. En primer lugar, este es un caso en el que incluimos el agua como reactivo. Las dos sustancias moleculares, el agua y el ácido acético, reaccionan para formar los iones poliatómicos hidronio y acetato. La ecuación que representa esto es una ecuación iónica. La segunda característica que merece una mayor discusión es la sustitución de la flecha hacia la derecha por el símbolo de las flechas dobles de una sola barra, que significa un equilibrio químico y, en este caso, la condición de equilibrio para la reacción favorece a los reactantes, lo que significa que en una solución acuosa de ácido acético, la mayor parte del ácido acético permanece como moléculas de ácido acético, y sólo una pequeña proporción ha cedido en algún momento H+ al agua para formar los iones. El pequeño número de iones producidos explica por qué la solución de ácido acético no conduce la electricidad tan bien como la solución de cloruro de sodio, dando como resultado sólo una débil iluminación de la bombilla de nuestro detector de conductividad. Por lo tanto, distinguimos entre electrolitos fuertes, como el cloruro de sodio, y el ácido acético, que es un ejemplo de electrolito débil.
Como el nombre de ácido acético sugiere, esta sustancia es también un ácido, así como un electrolito débil. En consecuencia, clasificamos el ácido acético como un ácido débil. Nuestra primera (y menos general) definición de un ácido es una sustancia que crea ion hidronio en el agua, que es justo lo que muestra nuestra ecuación iónica anterior, teniendo en cuenta que un ácido débil crea cantidades relativamente pequeñas de ion hidronio.
Los químicos son muy aficionados a las abreviaturas, y una abreviatura importante para el ion hidronio es H+(aq), y se utiliza habitualmente. Esto se muestra en la versión abreviada de la ecuación anterior que se muestra justo debajo. Para que quede claro, el propio H+ sería sólo un protón aislado (para el 1H); por lo tanto, también es importante señalar que no existe ninguna especie de este tipo en solución acuosa.
Además, las flechas se han hecho de longitud desigual para indicar el equilibrio favorecido por el reactante, en el que hay muchos menos iones que moléculas de ácido acético.
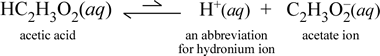
Al representar el hidronio como H+(aq), la ecuación iónica para el ácido acético en agua está formalmente equilibrada sin incluir una molécula de agua como reactante, lo que está implícito en la ecuación anterior.
Amoníaco: Un ejemplo de electrolito débil que es una base débil
El ácido acético como acabamos de ver es un compuesto molecular que es ácido débil y electrolito. El amoníaco, NH3, otro compuesto molecular simple, también reacciona en pequeña medida con el agua, formando iones amonio e hidróxido. Nuestra primera definición, la menos general, de una base es una sustancia que crea iones de hidróxido en el agua. Por tanto, el amoníaco es una base débil y, al igual que el ácido acético, no conduce la electricidad tan bien como la sal acuosa. Así que el amoníaco es un electrolito débil también.
![]()
El simbolismo de nuestra ecuación química indica de nuevo un equilibrio favorecido por el reactante para el electrolito débil.
Extensiones y conexiones
Un enfoque más cuantitativo del equilibrio utiliza ácidos débiles y bases débiles como ejemplos importantes.




