Cloruro de sodio, NaCl
El caso clásico de enlace iónico, la molécula de cloruro de sodio se forma por la ionización de átomos de sodio y cloro y la atracción de los iones resultantes.
Un átomo de sodio tiene un electrón 3s fuera de una envoltura cerrada, y sólo se necesitan 5,14 electronvoltios de energía para eliminar ese electrón. El cloro carece de un electrón para llenar una cáscara, y libera 3,62 eV cuando adquiere ese electrón (su afinidad electrónica es de 3,62 eV).Esto significa que sólo se necesita 1,52 eV de energía para donar uno de los electrones del sodio al cloro cuando están alejados. Cuando los iones resultantes se acercan, su energía potencial eléctrica se vuelve cada vez más negativa, alcanzando -1,52 eV a unos 0,94 nm de separación. Esto significa que si los átomos neutros de sodio y cloro se encontraran más cerca de 0,94 nm, sería energéticamente favorable transferir un electrón del Na al Cl y formar el enlace iónico.
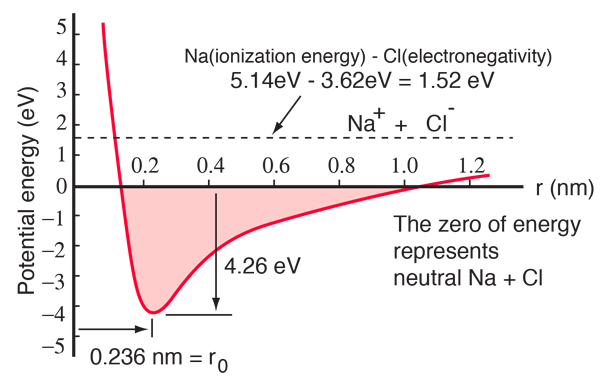
La curva de energía potencial muestra que hay un mínimo a 0,236 nm de separación y luego un aumento pronunciado del potencial que representa una fuerza repulsiva. Esta fuerza repulsiva es algo más que una repulsión electrostática entre las nubes de electrones de los dos átomos. Tiene un carácter mecánico cuántico enraizado en el principio de exclusión de Pauli, y a menudo se denomina simplemente «repulsión del principio de exclusión». Cuando los iones están muy separados, las funciones de onda de sus electrones centrales no se solapan significativamente y pueden tener números cuánticos idénticos. A medida que se acercan, el creciente solapamiento de las funciones de onda hace que algunos se vean obligados a pasar a estados de mayor energía. No hay dos electrones que puedan ocupar el mismo estado, por lo que al formarse un nuevo conjunto de estados de energía para el sistema compuesto de dos núcleos, los estados de energía más bajos se llenan y algunos de los electrones son empujados a estados más altos. Esto requiere energía y se experimenta como una repulsión, impidiendo que los iones se acerquen entre sí.
El diagrama de potencial anterior es para el NaCl gaseoso, y el entorno es diferente en el estado sólido normal donde el cloruro de sodio (sal de mesa común) forma cristales cúbicos. La separación de iones es de 0,28 nm, algo mayor que en el estado gaseoso.
Una parte importante del estudio de la estructura molecular es la descripción de los enlaces químicos que se forman entre los átomos. Los estudios clásicos son los extremos del enlace iónico en el cloruro de sodio y el enlace covalente en la molécula de hidrógeno.
| Enlaces químicos | Repulsión de Pauli en enlaces iónicos |
Ejemplo de energía de enlace




