Datos sobre el bario
El bario, llamado así por la palabra griega barys que significa «pesado», es un metal alcalinotérreo relativamente denso y reactivo. Sólo se encuentra de forma natural cuando se combina con otros elementos, y los compuestos que contienen bario tienen una amplia gama de usos; se encuentran en el veneno para ratas, en los agentes de ponderación de los fluidos de perforación petrolífera y en el líquido blanco que se utiliza para visualizar los intestinos en una prueba diagnóstica de rayos X llamada enema de bario.
Sólo los hechos
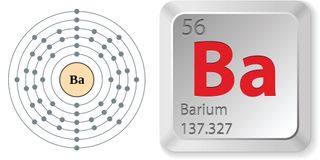
- Número atómico (número de protones en el núcleo): 56
- Símbolo atómico (en la tabla periódica de los elementos): Ba
- Peso atómico (masa media del átomo): 137,327
- Densidad: 2,09 onzas por pulgada cúbica (3.62 gramos por cm cúbico)
- Fase a temperatura ambiente: sólido
- Punto de fusión: 1.341 grados Fahrenheit (727 grados Celsius)
- Punto de ebullición: 3.447 F (1.897 C)
- Número de isótopos naturales (átomos del mismo elemento con diferente número de neutrones): 7
- Isótopo más común: Ba-138
Descubrimiento del bario
Vincenzo Casciarolo, un alquimista italiano del siglo XVII, observó por primera vez el bario en forma de guijarros inusuales que brillaban durante años tras ser expuestos al calor, según la Royal Society of Chemistry. Llamó a estos guijarros «piedras de Bolonia» en honor a su ciudad natal, pero posteriormente se determinó que eran sulfato de bario (BaSO4). A finales del siglo XVIII, el óxido de bario (BaO) y el carbonato de bario (BaCO3) fueron descubiertos por el químico alemán Carl Scheele y el químico inglés William Withering, respectivamente.
El bario metálico puro no fue aislado e identificado hasta 1808 en la Royal Institution de Londres. El destacado químico e inventor Sir Humphry Davy utilizó la electrólisis para separar el bario de las sales de bario fundidas, como el hidróxido de bario (Ba(OH)2). Durante la electrólisis, se hace pasar una corriente eléctrica a través de la sustancia iónica para separar los iones entre sí. Debido a que las sales de bario estaban fundidas, los iones de bario se movían fácilmente hacia el recipiente con el electrodo negativo, y los otros iones negativos se movían fácilmente en la dirección opuesta hacia el recipiente con el electrodo positivo.
Fuentes de bario
El bario se encuentra naturalmente sólo en combinación con otros elementos debido a su alto nivel de reactividad. El bario se encuentra más comúnmente combinado con sulfato y carbonato, pero también puede formar compuestos con hidróxido, cloruro, nitrato, clorato y otros iones negativos. Alrededor del 0,05% de la corteza terrestre es bario, lo que lo convierte en el 17º elemento más abundante de la corteza, según Robert E. Krebs en su libro «The History and Use of Our Earth’s Chemical Elements: A Reference Guide» (Greenwood Publishing Group, 2006). Las reservas mineras del Reino Unido, Italia, República Checa, Estados Unidos y Alemania contienen más de 400 millones de toneladas de bario, según John Emsley en su libro «Nature’s Building Blocks: An A-Z Guide to the Elements» (Oxford University Press, 1999).
Para obtener bario elemental puro, hay que separarlo de otros elementos presentes en los compuestos de bario naturales. El bario puede extraerse del cloruro de bario mediante electrólisis. El bario también puede obtenerse reduciendo el óxido de bario utilizando aluminio o silicio en un vacío a alta temperatura y baja presión.
Propiedades del bario
El bario puro es un metal blando y de color blanco plateado. Clasificado como metal alcalinotérreo, se encuentra en el grupo, o columna, 2 de la tabla periódica, junto con el berilio, el magnesio, el calcio, el estroncio y el radio. Cada uno de sus átomos contiene dos electrones de valencia (exteriores). El bario se encuentra en el periodo, o fila, 5, por lo que mantiene sus electrones de valencia en su quinta corteza y puede perder los electrones, o oxidarse, muy fácilmente. Esto explica el alto nivel de reactividad del bario, especialmente con elementos electronegativos como el oxígeno.
Usos comerciales del bario
El bario elemental no tiene muchos usos prácticos, de nuevo debido a su alto nivel de reactividad. Sin embargo, su fuerte atracción por el oxígeno lo hace útil como «captador» para eliminar los últimos restos de aire en los tubos de vacío. El bario puro también puede combinarse con otros metales para formar aleaciones que se utilizan para fabricar elementos de maquinaria como cojinetes o bujías en motores de combustión interna. Debido a que el bario tiene un agarre flojo de sus electrones, sus aleaciones emiten electrones fácilmente cuando se calientan y mejoran la eficiencia de las bujías, según Krebs.
Los compuestos que contienen bario tienen una variedad de usos comerciales. El sulfato de bario, o barita, se utiliza en la litopona (un pigmento abrillantador en el papel de imprenta y la pintura), en los fluidos de perforación de pozos de petróleo, en la fabricación de vidrio y en la creación de caucho. El carbonato de bario se utiliza como veneno para ratas, y el nitrato de bario y el clorato de bario producen colores verdes en los fuegos artificiales.
El bario en su cuerpo
El adulto medio contiene unos 22 mg de bario porque está presente en alimentos como las zanahorias, las cebollas, la lechuga, las judías y los cereales. De hecho, los niveles de bario en los dientes pueden ayudar a los científicos a determinar el momento en que los bebés pasan de ser amamantados a comer alimentos sólidos. Estos bajos niveles de bario no cumplen ninguna función biológica y no son perjudiciales.
Sin embargo, grandes cantidades de sales de bario solubles pueden ser tóxicas e incluso mortales, según John Emsley en su libro «The Elements of Murder: A History of Poison» (Oxford University Press, 2005). El bario puede provocar vómitos, cólicos, diarrea, temblores y parálisis. Ha habido un puñado de asesinatos con compuestos de bario, entre ellos el de un hombre en Mansfield, Texas, en 1994, a manos de su hija de 16 años, Marie Robards, que robó acetato de bario de su laboratorio de química del instituto. Varios pacientes también murieron accidentalmente por el bario cuando se utilizó por error carbonato de bario soluble en lugar de sulfato de bario insoluble durante una prueba de diagnóstico gastroenterológico (GI) llamada enema de bario.
Los médicos realizan enemas de bario para visualizar y diagnosticar anomalías del intestino grueso y el recto, según Johns Hopkins Medicine. Durante el procedimiento, se instila sulfato de bario a través del recto para recubrir las paredes internas del intestino grueso. A continuación, se suele administrar aire para asegurarse de que la capa de bario cubre todas las anomalías de la superficie. A continuación, se utilizan rayos X para obtener una imagen del tracto gastrointestinal inferior. El sulfato de bario absorbe los rayos X y aparece de color blanco en la película de rayos X, en contraste con el aire y el tejido circundante que aparecen de color negro. El análisis de la imagen radiográfica del enema de bario permite a los médicos diagnosticar trastornos como la colitis ulcerosa, la enfermedad de Crohn, los pólipos, el cáncer y el síndrome del intestino irritable.




