Definición de función de onda
Las partículas fundamentales, como los electrones, pueden describirse como partículas u ondas.
Los electrones pueden describirse utilizando una función de onda.El símbolo de la función de onda es la letra griega psi, Ψ o ψ.

La función de onda Ψ es una expresión matemática.Lleva información crucial sobre el electrón al que está asociada:a partir de la función de onda obtenemos la energía, el momento angular y la orientación orbital del electrón en forma de los números cuánticos n, l y ml.
La función de onda puede tener un signo positivo o negativo.El signo es importante en los cálculos.También es importante cuando las funciones de onda de dos o más átomos se combinan para formar una molécula.
Las funciones de onda con signos similares (ondas en fase) interferirán de forma constructiva, dando lugar a la posibilidad de enlace.Las funciones de onda con signos no similares (ondas desfasadas) interferirán de forma destructiva.
En 1926, Erwin Schrödinger dedujo la función de onda para el más simple de todos los átomos, el hidrógeno.La resolución de la ecuación de Schrödinger permite a los científicos determinar las funciones de onda de los electrones en átomos y moléculas.
La ecuación de Schrödinger es una ecuación de la mecánica cuántica: las funciones de onda calculadas tienen valores discretos y permitidos para los electrones unidos en átomos y moléculas; todos los demás valores están prohibidos.
Además de la importancia de Ψ, su cuadrado Ψ2 también tiene una enorme importancia en la química.
Ψ2 es la densidad de probabilidad.Nos dice dónde es más probable que se encuentre el electrón en el espacio que rodea al núcleo.
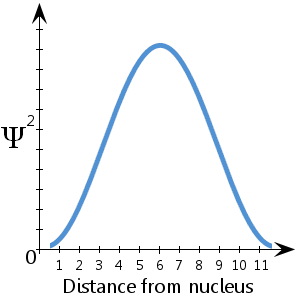
Por ejemplo, en el diagrama esquemático (ficticio) representado aquí, que muestra Ψ2 frente a la distancia al núcleo, vemos que es más probable que el electrón se encuentre entre unas 5-7 unidades del núcleo.También vemos que hay una probabilidad insignificante de que el electrón se encuentre en el núcleo o a más de unas 11½ unidades del núcleo.
Hay una probabilidad del 100 por ciento de que el electrón esté en algún lugar – en otras palabras, una probabilidad de 1.
Ψ puede calcularse exactamente sólo para átomos con un electrón, es decir, H, He+, Li2+, Be3+, B4+, C5+, etc.En lenguaje matemático, decimos que las soluciones analíticas para Ψ son posibles sólo para sistemas de un electrón.Los sistemas de un electrón se describen a menudo como hidrogenéticos – lo que significa «como el hidrógeno.»
Para todos los demás átomos, iones y moléculas, no son posibles soluciones analíticas para Ψ; son necesarios métodos de aproximación para calcularlo.
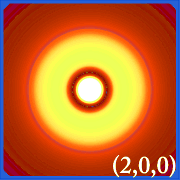
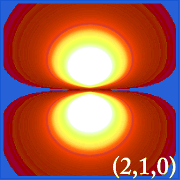
Ψ2 y Orbitales Hidrogénicos
Planificando la densidad de probabilidad del hidrógeno (i.e. Ψ2) para diferentes números cuánticos nos permite visualizar el espacio, centrado en el núcleo, que ocupan los electrones.Las diferentes distribuciones de Ψ2 son los orbitales electrónicos del hidrógeno.El orbital que se ocupa realmente está determinado por la cantidad de energía que tiene el electrón.
Ejemplos de orbitales del hidrógeno