Fronteras en Farmacología
Introducción
La olanzapina es uno de los antipsicóticos de segunda generación (AGS) más utilizados para la esquizofrenia, el trastorno bipolar y los síntomas psicóticos. Además de mejorar los principales síntomas de la psicosis, la olanzapina muestra una gran aceptabilidad, disminuye la interrupción por cualquier causa y previene futuras recaídas (Leucht et al., 2009). Muchos ensayos clínicos aleatorios (ECA) y metaanálisis han sugerido que la olanzapina es uno de los fármacos antipsicóticos más eficaces en pacientes con esquizofrenia (Leucht et al., 2013; Huhn et al., 2019).
Los efectos adversos más comunes de la olanzapina son el aumento de peso (Allison et al., 1999). Olanzapina provoca el mayor aumento de peso de los AGS. El ensayo Comparison of Atypicals for First Episode (CAFE) demostró que el 80% de los pacientes tratados con olanzapina ganaron más del 7% de su peso corporal inicial en la semana 52 (McEvoy et al., 2007). La tasa de interrupción de la olanzapina debido al aumento de peso o a los efectos metabólicos acompañantes fue de 2 a 8 veces mayor que la de otros antipsicóticos en el ensayo Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE) (Lieberman et al., 2005). Además de asociarse con una menor adherencia al tratamiento farmacológico, el aumento de peso también se asocia con una importante morbilidad y mortalidad médica. Teniendo en cuenta la elevada tasa de obesidad en los pacientes con esquizofrenia (42%), debe evaluarse cuidadosamente el riesgo potencial de aumento de peso inducido por la olanzapina (Newcomer, 2006). Algunos estudios de ensayos controlados aleatorios (ECA) han encontrado que los pacientes con enfermedades mentales mueren hasta 30 años antes que la población general (Das-Munshi et al., 2017). La principal causa de muerte en esta población es la enfermedad cardíaca. Un factor de riesgo importante para la enfermedad cardíaca y la muerte prematura en estos pacientes es el aumento de peso (Fekadu et al., 2015).
Los mecanismos subyacentes al aumento de peso inducido por los antipsicóticos y los efectos metabólicos adversos no se conocen bien (Correll et al., 2011). La olanzapina se asocia a un aumento del apetito y de la ingesta de alimentos y a una disminución de la actividad o a una alteración de la regulación metabólica (Roerig et al., 2005; Henderson et al., 2015). Fountaine et al. informaron de que, en hombres sanos, la olanzapina aumentaba el peso corporal a través de una mayor ingesta de alimentos, sin evidencia de una disminución de los niveles de actividad o gasto (Fountaine et al., 2010). Esta observación concuerda con las observaciones realizadas en pacientes adolescentes varones con esquizofrenia (Gothelf et al., 2002). Los pacientes tenían un índice de masa corporal significativamente mayor debido al aumento de la ingesta calórica después de 4 semanas de tratamiento con olanzapina (Gothelf et al., 2002). Sin embargo, las pruebas actuales sobre la asociación del apetito con el aumento de peso no son concluyentes (Poyurovsky et al., 2007; Case et al., 2010). Case et al. informaron de que los cambios tempranos en el apetito no estaban correlacionados de forma consistente con el cambio de peso general en cuatro ensayos diferentes (Case et al., 2010). Además, ningún estudio ha informado del momento exacto del aumento del apetito, ni ha comparado la velocidad de aumento de peso en relación con el momento del aumento del apetito, ni ha evaluado las diferencias en el aumento de peso y los efectos metabólicos entre los pacientes con apetito aumentado o sin cambios. Por lo tanto, se evaluó la asociación entre el aumento del apetito y los cambios de peso inducidos por la olanzapina y los efectos metabólicos que la acompañan en pacientes de primer episodio de esquizofrenia no tratados con medicamentos.
Materiales y métodos
Participantes
Este estudio se llevó a cabo en el Instituto de Salud Mental del Segundo Hospital de Xiangya, Universidad Central del Sur, China, entre diciembre de 2016 y abril de 2019. Los participantes fueron evaluados para la esquizofrenia de acuerdo con los criterios definidos por el Manual Diagnóstico y Estadístico de los Trastornos Mentales – Quinta Edición (DSM-5) (A.P. Association, 2013). Como los pacientes sin antipsicóticos/primer episodio parecen ganar más peso después del tratamiento con olanzapina (Correll et al, 2011), se incluyeron en este estudio pacientes con esquizofrenia de primer episodio de entre 18 y 50 años.
Los criterios de exclusión incluyeron (i) hallazgos clínicamente anormales de los exámenes físicos, las pruebas de laboratorio o los resultados del electrocardiograma (ECG); (ii) trastornos como la discapacidad intelectual, el trastorno por consumo de sustancias o alcohol, un diagnóstico de otras enfermedades sistémicas específicas según los criterios del DSM-5; (iii) enfermedades cardiovasculares y metabólicas como la diabetes mellitus, la dislipidemia y la hipertensión; (iv) antecedentes de trastornos alimentarios; (v) dieta estricta en el mes anterior al cribado o durante el estudio; y (vi) embarazo o lactancia.
Intervención
Estudios anteriores han sugerido que la tasa de aumento de peso inducido por la olanzapina fue más rápida durante las primeras 12 semanas de tratamiento (Correll et al, 2009). Por lo tanto, los participantes fueron tratados con olanzapina (15-20 mg/día a las 8:00 p.m.) durante 12 semanas. La dosis inicial de olanzapina fue de 5 mg/día y luego se ajustó a 15-20 mg/día en la primera semana.
Evaluación
Las evaluaciones iniciales incluyeron datos demográficos, una historia clínica completa, medidas antropométricas (peso y altura), apetito, examen físico y análisis de laboratorio. El apetito se evaluó diariamente, 30 minutos antes del almuerzo, con cuatro preguntas estandarizadas: Hambre, Sensación de saciedad, Pensar en la comida y Comer en exceso. Las respuestas se calificaron en una escala de 0 a 10, donde 0 = «nada» y 10 = «extremadamente». El aumento del apetito se definió como un incremento de >10% en las puntuaciones iniciales del apetito. La disminución del apetito se definió como un >10% de disminución en las puntuaciones del apetito basal. Se utilizó la Escala de Síndrome Positivo y Negativo (PANSS) para evaluar la gravedad de los síntomas de la esquizofrenia. Los efectos adversos se evaluaron mediante la Escala de Síntomas Emergentes del Tratamiento (TESS). En cada visita de seguimiento, se repitieron todas las evaluaciones basales (incluyendo el examen físico, las medidas antropométricas, el apetito y la TESS), excepto la PANSS. La PANSS se volvió a evaluar en la semana 12.
Antes del tratamiento y en estado de ayuno, se midieron el peso y la altura después de que los participantes se quitaran los zapatos con ropa interior ligera. El apetito se evaluó antes de la comida y se basó en el juicio del médico calificador el día del examen. Las pruebas de laboratorio, incluyendo la glucosa en plasma, la función hepática y renal, se evaluaron mediante procedimientos enzimáticos con el analizador químico automatizado Boehringer Mannheim/Hitachi 714. La insulina se midió con un ensayo inmunoenzimático de fase sólida (ELISA).
Los resultados primarios fueron el porcentaje de pacientes que tuvieron un aumento del apetito y el período de tiempo entre el tratamiento con olanzapina y el aumento del apetito. Los resultados secundarios incluyeron cambios en el peso, el índice de masa corporal (IMC), la glucosa en ayunas, la insulina en ayunas y el índice de resistencia a la insulina, los perfiles lipídicos que incluían los triglicéridos, el colesterol, la lipoproteína de alta densidad (HDL-C) y la lipoproteína de baja densidad (LDL-C), y la puntuación de la PANSS. El IMC se calculó según los criterios del Grupo de Trabajo sobre Obesidad en China: peso saludable (18,5 ≤ IMC <25 kg/m2), sobrepeso (25 ≤ IMC ≤ 28 kg/m2) y obesidad (IMC > 28 kg/m2). La dislipidemia se definió como colesterol ≥ 5,18 mmolċl-1, triglicéridos ≥ 1,70 mmolċl-1, HDL-C < 1,04 mmolċl-1, o LDL-C ≥ 3,37 mmolċl-1 en base a las directrices chinas para la dislipidemia (Hu, 2017). También se incluyó un análisis de la proporción de pacientes que ganaron más del 7% de su peso corporal inicial después de 12 semanas, que es el punto de corte para el aumento de peso clínicamente significativo (Kanders et al., 1991).
Análisis estadístico
Statistical Package for Social Sciences, versión 25.0 (SPSS v25.0) se empleó para el análisis estadístico. Las variables continuas y las categóricas se describen mediante estadísticas de resumen (medias y desviaciones estándar) o frecuencias y porcentajes, respectivamente. Se utilizó la prueba t de Student y el análisis chi-cuadrado para analizar las diferencias entre grupos en los cambios del peso corporal, el IMC, la glucosa y la insulina en ayunas, el índice de resistencia a la insulina, los triglicéridos, el colesterol, el cHDL y el cLDL desde el inicio hasta cada punto temporal. Se investigó la asociación entre el peso, el IMC, el índice de resistencia a la insulina, el LDL-C y el apetito mediante un análisis de regresión lineal. Un valor P (p) < 0,05 se consideró estadísticamente significativo.
Resultados
En total, se incluyeron en el estudio 33 pacientes internos con esquizofrenia (edad media, 23,5 años; rango 18-36 años). Hubo una mayor proporción de pacientes mujeres (63,6%, 21/33). Todos los pacientes estaban en el rango de IMC normal (IMC medio, 21,3 ± 1,7 kg/m2). La duración media de la esquizofrenia fue de 11,2 ± 3,7 (rango 5-18) meses. Dos pacientes femeninos abandonaron el estudio después de 4 semanas debido al aumento del apetito; los 31 (93,9%) participantes restantes completaron el estudio (Tabla 1).
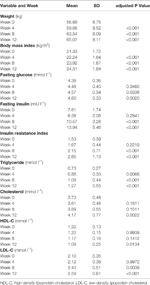
Tabla 1 Resumen de las medidas de peso y metabólicas por estudio.
Aumento del apetito tras el tratamiento con olanzapina
Después de 12 semanas de tratamiento con olanzapina, el 77,4% (24/31) de los pacientes tuvieron un aumento del apetito y el 22,6% (7/31) de los pacientes tuvieron un apetito sin cambios. Como se muestra en la Figura 1, para los 24 pacientes que tuvieron un aumento del apetito, éste comenzó dentro de las primeras 8 semanas de tratamiento con olanzapina y duró hasta el final del tratamiento. El tiempo medio transcurrido desde el inicio del tratamiento con olanzapina hasta el aumento del apetito fue de 20,3 días (DE = 14,4), y el 25,0% (6/24) y el 70,8% (17/24) aumentaron su apetito en el plazo de 1 semana y 4 semanas, respectivamente. Dos pacientes aumentaron su apetito en el tercer día después del tratamiento con olanzapina. No se encontraron diferencias significativas en el apetito inducido por la olanzapina entre los distintos géneros mediante un análisis de dos vías ANOVA.
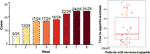
Figura 1 Número de pacientes con aumento del apetito durante los períodos de tratamiento con olanzapina de 8 semanas.
Cambios de peso corporal e IMC tras el tratamiento con olanzapina
Se observaron aumentos significativos de peso e IMC tras el tratamiento con olanzapina (Tabla 1). El aumento de peso medio fue de 7,9 kg durante el período de 12 semanas de tratamiento con olanzapina, y los pacientes aumentaron 2,4, 4,0 y 1,5 kg en el primer, segundo y tercer período de 4 semanas, respectivamente. Las pacientes femeninas eran más propensas a ganar peso (P < 0,001), con un aumento de peso medio de 9,19 kg durante el período de estudio, en comparación con el aumento de peso de 5,90 kg en los pacientes masculinos. Del total de pacientes, el 80,6% (25/31) y el 61,3% (19/31) aumentaron su peso corporal inicial en más de un 7% y un 10%, respectivamente, durante las 12 semanas de tratamiento con olanzapina (Tabla suplementaria 1). Después de 12 semanas, el 51,6% (16/31) de los pacientes adquirieron sobrepeso (IMC>25 kg/m2).
Cambios de las alteraciones metabólicas tras el tratamiento con olanzapina
Se observaron aumentos significativos de la glucosa en ayunas, la insulina en ayunas, el índice de resistencia a la insulina, los triglicéridos, el colesterol y el LDL-C y disminuciones del HDL-C a las 12 semanas (Tabla 1). Ningún paciente incluido en el estudio tenía dislipidemia al inicio del estudio. Según las directrices chinas para la dislipidemia, el 38,7% (12/31) de los pacientes tenían dislipidemia después de 12 semanas de tratamiento con olanzapina.
Aumento del apetito y aumento de peso inducido por la olanzapina
Para detectar el efecto del aumento del apetito en el aumento de peso inducido por la olanzapina, dividimos a los pacientes en dos grupos (grupo de aumento del apetito y grupo de apetito sin cambios ) en función de si el apetito aumentaba o no después de 12 semanas de tratamiento con olanzapina.
En comparación con el grupo de apetito sin cambios, hubo aumentos significativos en los niveles de peso e IMC en el grupo de aumento del apetito después de 12 semanas de tratamiento con olanzapina (Tabla 2). La figura 2 mostraba la comparación del aumento de peso y los resultados relacionados con el metabolismo entre los grupos de aumento del apetito y de mantenimiento del mismo. Los análisis detallados se presentaron en la Tabla Suplementaria 2. El aumento de peso entre los dos grupos fue significativo (P = 0,01) mediante un análisis ANOVA de dos vías. El peso medio aumentó en 9,1 kg (DE = 4,1) en el grupo de aumento del apetito y 3,9 kg (DE = 2,0) en el grupo de apetito sin cambios, con una diferencia significativa entre los dos grupos durante el período de tratamiento con olanzapina de 12 semanas. Un mayor porcentaje de pacientes (91,7%) en el grupo de apetito aumentado ganó más del 7% de su peso corporal inicial después de 12 semanas en comparación con los pacientes del grupo de apetito sin cambios (42,9%; χ2 = 8,27, df = 1, p = 0,004). Del mismo modo, más pacientes del grupo de apetito aumentado (19/24, 79,2%) ganaron más del 10% del peso corporal inicial después de 12 semanas en comparación con los pacientes del grupo de apetito sin cambios (0,0%; χ2 = 14,32, df = 1, p < 0,001) (Tablas suplementarias 3-5). Tras 12 semanas de tratamiento con olanzapina, el 58,3% de los pacientes adquirió sobrepeso en el grupo de aumento del apetito, en comparación con el 28,6% de los pacientes del grupo de apetito sin cambios. El aumento del apetito medió fuertemente el aumento de peso inducido por la olanzapina, con un efecto mediador del 66,2%.

Tabla 2 Estadísticas descriptivas de las medidas de resultado entre los grupos de apetito aumentado y no cambiado al inicio, y en las semanas 4, 8 y 12.
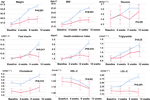
Figura 2 Comparación del peso corporal, el IMC, la glucosa y los niveles de lípidos entre los grupos con apetito aumentado y sin cambios. La línea azul indica los pacientes con aumento del apetito; la línea roja indica los pacientes con apetito sin cambios.
Aumento del apetito y alteraciones metabólicas inducidas por la olanzapina
Hubo diferencias significativas en la insulina (p = 0,017), el índice de resistencia a la insulina (p = 0,015) y el LDL-C (p = 0,001) entre los grupos de aumento del apetito y sin cambios después de 12 semanas (Figura 2 y Tabla 2). Cuatro pacientes del grupo de aumento del apetito tenían un colesterol ≥ 5,18 mmolċl-1, nueve tenían triglicéridos ≥ 1,70 mmolċl-1, seis tenían un HDL-C < 1,04ċmmol l-1, y tres tenían un LDL-C ≥ 3,37 mmolċl-1 en la semana 12. En total, 13/24 pacientes del grupo de apetito aumentado tenían dislipidemia después de 12 semanas, mientras que ninguno de los pacientes del grupo de apetito sin cambios desarrolló dislipidemia durante el período de estudio (Tabla 3).

Tabla 3 Dislipidemia definida por cada medida de resultado individual en los grupos de apetito aumentado y sin cambios.
El pico de aumento de peso alcanzado 1 mes después del mes de aumento del apetito
En el grupo de aumento del apetito, se analizó la media de aumento de peso de cada paciente en cuatro puntos temporales: antes del mes de aumento del apetito (-1M), el mes de aumento del apetito (0M), un mes después del aumento del apetito (+1M) y dos meses después del aumento del apetito (+2M). En comparación con -1M, hubo un aumento de peso en 0M, pero este cambio no fue significativo (-1M frente a 0M, 1,4 ± 1,2 kg frente a 3,1 ± 1,4 kg). La ganancia de peso entró en el pico de crecimiento a +1M, con un aumento de 4,3 ± 2.4 kg de aumento. El crecimiento de peso se desaceleró a +2M (p < 0,001) en 1,6 ± 1,5 kg. El aumento de peso a +2M se ralentizó y estabilizó, y no se observaron diferencias significativas cuando se comparó con -1M (Figura 3 y Tabla Suplementaria 6).
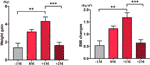
Figura 3 Velocidad media de aumento de peso en el grupo de apetito aumentado. Se analizó el aumento de peso medio de cada paciente por mes durante el período de estudio en cuatro puntos temporales: antes del mes de tiempo de aumento del apetito (-1M), el mes de tiempo de aumento del apetito (0M), 1 mes después del mes de tiempo de aumento del apetito (+1M), y 2 meses después del mes de tiempo de aumento del apetito (+2M). ** indica P < 0,01, *** indica P < 0,001.
El aumento temprano del apetito predice un mayor aumento de peso en 1 mes después del mes de aumento del apetito
Comparamos además la velocidad de aumento de peso de los participantes con aumento del apetito en 4 semanas (A) y de los participantes con aumento del apetito entre 4 y 8 semanas (B). En 0M, las velocidades de aumento de peso entre los participantes con aumento de apetito en 4 semanas y los participantes con aumento de apetito entre 4 y 8 semanas no fueron significativamente diferentes. Sin embargo, los participantes con aumento de apetito más temprano mostraron una velocidad de aumento de peso significativamente mayor a +1M. Estos resultados demostraron que un aumento del apetito más temprano podría conducir a un mayor aumento de peso durante el periodo de seguimiento (Figura 4). Se observaron cambios similares en el IMC durante los cuatro puntos temporales (Figuras 3 y 4).
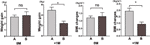
Figura 4 Comparación de la velocidad de aumento de peso de los participantes con aumento del apetito en diferentes meses. Se comparó la velocidad de aumento de peso de los participantes con aumento de apetito en un plazo de 4 semanas (A) y de los participantes con aumento de apetito entre 4 y 8 semanas (B) en el mes de tiempo al aumento de apetito (0M) y 1 mes después del mes de tiempo al aumento de apetito (+1M). ns, indica no significativo, * indica P < 0,05.
El apetito y la velocidad de los cambios de las alteraciones metabólicas
Los datos descriptivos detallados de los cambios en el peso, el IMC, la glucosa en ayunas, la insulina, el índice de resistencia a la insulina, los triglicéridos, el colesterol, el HDL-C y el LDL-C se resumen en la Tabla 2 Para investigar la asociación entre el aumento del apetito y el metabolismo de la glucosa y los lípidos, se analizaron los cambios en estos indicadores en cuatro puntos temporales en el grupo de aumento del apetito. No se observaron cambios significativos en la velocidad de la glucosa, los triglicéridos, el cHDL y el cLDL en ningún momento. Sólo se observaron aumentos significativos en las velocidades de la insulina y del índice de resistencia a la insulina en +2M (Figura suplementaria 1 y Tabla suplementaria 6). Otras comparaciones sugirieron que los participantes con aumento del apetito en las primeras 4 semanas no mostraron un aumento significativo de la velocidad de la insulina y del índice de resistencia a la insulina a 0M y +1M en comparación con los participantes con aumento del apetito entre 4 y 8 semanas (Figura suplementaria 2).
La predicción del apetito sobre el aumento de peso inducido por la olanzapina y las alteraciones metabólicas
Realizamos un análisis de regresión lineal para evaluar el efecto del aumento del apetito sobre el aumento de peso, la glucosa en sangre y los niveles de lípidos. Después de controlar las variables estadísticamente significativas como el sexo, la edad, la altura y la duración, incluimos el aumento de peso, el IMC, la glucosa en ayunas, la insulina, el índice de resistencia a la insulina, los triglicéridos, el colesterol, el HDL-C y el LDL-C como variables dependientes y el apetito como variable independiente en el análisis de regresión. El aumento del apetito se asoció con cambios en el peso (β = 0,67, p =0,0003), el IMC (β = 0,63, p = 0,0004), la insulina (β = 0,49, p = 0,019), el índice de resistencia a la insulina (β = 0,51, p = 0,0149) y el LDL-C (β = 0.61, p = 0,0035) (Tabla Suplementaria 7).
Se observaron mejoras significativas de los síntomas clínicos (evaluados por la PANSS, p < 0,001) desde el punto de partida hasta el final del tratamiento con olanzapina. No se observaron diferencias significativas en la PANSS entre los grupos de aumento del apetito y de mantenimiento del apetito (p > 0,05).
Efectos adversos
Entre los 31 pacientes que completaron el estudio, nueve (29.0%) informaron de hipoactividad, ocho (25,8%) pacientes informaron de somnolencia, cuatro (12,9%) pacientes tuvieron pruebas hepáticas anormales, dos (6,5%) pacientes informaron de acatisia, cuatro (12,9%) pacientes tuvieron estreñimiento, uno (3.El 80,6% (25/31) de los pacientes aumentaron su peso corporal en más de un 7% durante el período de estudio.
Discusión
En este estudio prospectivo, los principales hallazgos mostraron que el 77,4% de los pacientes aumentaron su apetito después del tratamiento con olanzapina, y estos pacientes que aumentaron su apetito ganaron más peso que los pacientes con apetito sin cambios (9,1 kg frente a 3,9 kg). Del mismo modo, un mayor número de pacientes en el grupo de aumento del apetito incrementó su peso corporal inicial en más de un 7 o 10%, lo que sugiere que el aumento del apetito se asocia con un aumento de peso sustancial en los pacientes con esquizofrenia de primer episodio sin tratamiento farmacológico tratados con olanzapina. Además, el análisis de regresión lineal también apoyó que el aumento del apetito estaba fuertemente relacionado con el aumento de peso inducido por la olanzapina. Estos resultados concuerdan con informes anteriores (Gothelf et al., 2002; Cope et al., 2005). Murashita et al. (2005) observaron un aumento de los niveles de grelina estimulante del apetito y del porcentaje de grasa corporal en pacientes con esquizofrenia tratados con olanzapina. Los resultados de un estudio aleatorizado a doble ciego sugirieron que la olanzapina inducía la ansiedad por la comida y los atracones en mayor medida que la clozapina (Murashita et al., 2005; Kluge et al., 2007). También se informó de resultados similares en ratones tratados con olanzapina (Cope et al., 2005). La acción de la olanzapina sobre múltiples sitios receptores, especialmente los receptores D2 y 5H3, que modulan el apetito, también se ha aplicado en el tratamiento de la anorexia nerviosa y de las náuseas y vómitos inducidos por la quimioterapia (Kluge et al., 2007; Tan et al., 2009; Kafantaris et al., 2011).
También encontramos que el 70,8% de los pacientes aumentaron su apetito dentro de las primeras 4 semanas de tratamiento inicial con olanzapina, con una media de 20,3 días para el aumento. Algunos pacientes incluso aumentaron su apetito ya en el tercer día después del tratamiento con olanzapina. Resulta interesante que los pacientes cuyo apetito aumentó antes en el tiempo tenían más probabilidades de ganar peso que los pacientes cuyo apetito aumentó más tarde en el tiempo, y el aumento de peso alcanzó su punto máximo al mes de producirse el aumento del apetito. Aunque no se encontraron diferencias significativas en el apetito inducido por la olanzapina entre hombres y mujeres, los pacientes femeninos tenían más probabilidades de ganar peso (P < 0,001). Por lo tanto, el apetito debe considerarse como un indicador para predecir el aumento de peso inducido por la olanzapina, especialmente en los pacientes femeninos. En el ámbito clínico, los médicos deberían prestar más atención a los pacientes cuyo apetito aumenta tempranamente después del tratamiento con olanzapina y deberían iniciar un plan para prevenir el peso.
Los pacientes tratados con olanzapina mostraron un aumento de más del 7% del peso corporal inicial, lo que concuerda con hallazgos anteriores (Gothelf et al., 2002; Wu et al., 2008). Además del significativo aumento de peso, los pacientes con tratamiento con olanzapina presentaban un metabolismo de la glucosa y de los lípidos significativamente perturbado después de 12 semanas, lo que coincide con las observaciones publicadas anteriormente en pacientes con esquizofrenia (Correll et al., 2011). En comparación con los pacientes del grupo de apetito sin cambios, el grupo de apetito aumentado presentaba anomalías lipídicas significativas. La glucosa en ayunas no fue significativamente diferente entre los dos grupos. Los participantes con aumento temprano del apetito no mostraron un aumento de la velocidad de la insulina y del índice de resistencia a la insulina en los meses siguientes al aumento del apetito. Es posible que los niveles de glucosa sean independientes del aumento de peso, ya que el apetito no afectó a los niveles de glucosa.
Los resultados adversos para la salud física asociados a los antipsicóticos, como el aumento de peso, las alteraciones metabólicas y la morbilidad relacionada, han sido reconocidos desde hace tiempo (Wu et al., 2016). Estudios anteriores han sugerido que el apetito puede predecir el aumento de peso inducido por la olanzapina y los efectos metabólicos adversos (Gothelf et al., 2002; Poyurovsky et al., 2007; Fountaine et al., 2010). Hasta donde sabemos, este es el primer estudio que evalúa la asociación entre el apetito, el aumento de peso y las alteraciones metabólicas tras el tratamiento con olanzapina en pacientes con esquizofrenia en primer episodio que no han recibido fármacos. Algunos hallazgos nos dan más evidencias sobre cómo elegir razonablemente la medicación en el trabajo clínico y dan más beneficios para prevenir el aumento de peso y las alteraciones metabólicas inducidas por la olanzapina.
Hay varias limitaciones en nuestro estudio. En primer lugar, este estudio no midió la ingesta de alimentos, como las comidas y los tentempiés, aunque a todos los pacientes incluidos se les proporcionó el mismo menú alimentario estandarizado. La ingesta elevada de grasas y fructosa puede disminuir el control del apetito al afectar a la regulación central del mismo. De hecho, las dietas con alto contenido en fructosa tienen efectos adversos sobre la señalización central del apetito y la función cognitiva (Lowette et al., 2015; Dalvi et al., 2017). En segundo lugar, no examinamos los niveles de leptina y grelina durante el periodo de estudio. Secretadas por el tejido adiposo y el estómago, respectivamente, la leptina y la grelina desempeñan papeles cruciales en la regulación de la ingesta de alimentos y el metabolismo energético (Cui et al., 2017). Varios estudios encontraron un aumento del nivel de leptina y una disminución del nivel de grelina en las primeras semanas tras el inicio del tratamiento con olanzapina (Basoglu et al., 2010; Stip et al., 2012; Lu et al., 2015). El aumento del nivel de leptina se mantiene estable durante varias semanas, pero el nivel de grelina aumenta en el período más largo (Sentissi et al., 2008). Otras investigaciones deberían controlar las respuestas de la leptina y la grelina al aumento del apetito, así como sus relaciones con los parámetros metabólicos y los efectos clínicos. Además, no se controlaron los niveles de actividad durante el período de estudio. Aunque algunos estudios informaron que la olanzapina aumentó el peso corporal únicamente por el aumento del apetito y la ingesta de alimentos, sin diferencias significativas en el gasto energético en reposo (Gothelf et al., 2002; Fountaine et al., 2010). Varios estudios informaron de la reducción de las actividades físicas con la medicación con olanzapina (Pérez-Cruzado et al., 2018). En nuestro estudio, el 29,0% de los pacientes informó de hipoactividad y el 25,8% de los pacientes informó de somnolencia durante el período de tratamiento con olanzapina de 12 semanas. Hillebrand et al. (2005) encontraron que el tratamiento con olanzapina redujo la actividad física en ratas expuestas a la anorexia basada en la actividad. El tratamiento con olanzapina también redujo los niveles de actividad de los pacientes con anorexia nerviosa, sin diferencias significativas en el peso corporal y los niveles de leptina en plasma en comparación con los pacientes no tratados. Nuestro estudio anterior demostró que las intervenciones en el estilo de vida, que incluían programas psicoeducativos, dietéticos y de ejercicio, pueden reducir el aumento de peso inducido por los antipsicóticos (Wu et al., 2008). Además, sería mejor comparar más pacientes con controles sanos de edad similar, lo que puede ayudar a interpretar que el aumento del apetito inducido por la olanzapina y los cambios metabólicos están específicamente relacionados con sus propiedades farmacológicas. Otros estudios deberían centrarse en los mecanismos del aumento del apetito tras el tratamiento con olanzapina (Koopmann et al., 2012; Sweeney et al., 2017; Mancuso et al., 2019). El sistema de recompensa en las regiones estriatales puede estar relacionado con el aumento de peso asociado a los antipsicóticos (Nielsen et al., 2016). La actividad alterada en la corteza cingulada anterior subgenual también puede subyacer en parte al aumento del apetito tras el tratamiento con olanzapina (Pawlowski et al., 2018). Deben realizarse estudios de imagen para investigar la modulación de la olanzapina de la actividad cerebral profunda relacionada con el apetito.
Conclusiones
En conclusión, nuestro estudio ha demostrado que el apetito está relacionado con el aumento de peso inducido por la olanzapina y la dislipidemia en pacientes con esquizofrenia en primer episodio que no han recibido ningún fármaco. La evaluación de los cambios en el apetito es una forma fácil y práctica de predecir el aumento de peso, lo que proporciona a los clínicos más tiempo y opciones para las estrategias de intervención. Las invenciones dietéticas tempranas dirigidas a disminuir el apetito y reducir la ingesta de alimentos pueden ser útiles para el control de peso en pacientes con esquizofrenia tratados con olanzapina.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración ética
Este estudio se realizó de acuerdo con la Declaración de Helsinki (Asociación G.A.o.t.W.M., 2013), y fue aprobado por el Comité de Ética del Segundo Hospital de Xiangya, Universidad Central del Sur. Después de una descripción completa del estudio a los participantes, se obtuvo el consentimiento informado antes de la participación en el estudio.
Contribuciones de los autores
JH analizó e interpretó los datos de los pacientes y fue uno de los principales colaboradores en la redacción del manuscrito. G-RH diseñó y realizó principalmente el estudio. YeY, C-CL, J-MX, Y-JL, y X-JP ayudó en el reclutamiento de pacientes, el control de la calidad de los datos, y el documento de los eventos adversos emergentes del tratamiento. YiY ayudó a revisar el manuscrito. J-PZ orientó el diseño del estudio. RR-W fue responsable del contenido general. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
Este trabajo fue apoyado por los Proyectos del Programa Clave de R&D, la Fundación Nacional de Ciencias de China (Subvención No.2016YFC1306900) y la Fundación Nacional de Ciencias Naturales de China (Subvención No.81622018 y nº 81901401).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Deseamos agradecer la valiosa contribución de los participantes y el apoyo de sus médicos de cabecera. También queremos agradecer a varios revisores anónimos sus valiosos comentarios y sugerencias para mejorar la calidad del artículo.
Material complementario
El material complementario de este artículo puede encontrarse en línea en: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Material Suplementario Figura 1 | Velocidad de los cambios de glucosa y lípidos en sangre en el grupo de aumento del apetito. Se analizaron los valores de cambio medio de cada paciente por mes durante el período de estudio en cuatro puntos temporales: antes del mes de tiempo de aumento del apetito (-1M), el mes de tiempo de aumento del apetito (0M), 1 mes después del mes de tiempo de aumento del apetito (+1M), y 2 meses después del mes de tiempo de aumento del apetito (+2M).
Suplemento Figura 2 | Comparación de las velocidades de cambio de la insulina y del índice de resistencia a la insulina de los participantes con aumento del apetito en diferentes meses. Se comparó la velocidad de los participantes con un aumento del apetito en un plazo de 4 semanas (A) y de los participantes con un aumento del apetito entre 4-8 semanas (B) en el mes de tiempo para el aumento del apetito (0M) y 1 mes después del mes de tiempo para el aumento del apetito (+1M).
Tabla 1 del suplemento | Número de pacientes que habían aumentado el peso corporal inicial en más del 7% o del 10% en las semanas 4, 8 y 12.
Tabla 2 del suplemento | Número de pacientes que habían aumentado el peso corporal inicial en más del 7% o del 10% en las semanas 4, 8 y 12 en los pacientes con aumento del apetito.
Tabla del suplemento 3 | Número de pacientes que habían aumentado el peso corporal inicial en más de un 7% o 10% en las semanas 4, 8 y 12 en pacientes con apetito sin cambios.
Tabla del suplemento 4 | Comparación de los números de aumento de peso del 7% o 10% entre los pacientes con apetito aumentado y los pacientes con apetito sin cambios en las semanas 4, 8 y 12.
Supplemento Tabla 5 | El análisis de la velocidad de la ganancia de peso media, la glucosa, y los cambios de lípidos en el grupo de aumento del apetito en cuatro puntos de tiempo: antes del mes de tiempo para aumentar el apetito (-1M), el mes de tiempo para aumentar el apetito (0M), 1 mes después del mes de tiempo para aumentar el apetito (+1M), y 2 meses después del mes de tiempo para aumentar el apetito (+2M). ns indica que no es significativo, * indica un valor p < 0,05, ** indica un valor p < 0,01, *** indica un valor p < 0,001.
Suplemento Tabla 6 | Estimaciones de los efectos del apetito sobre el aumento de peso y las medidas de resultado relacionadas con el metabolismo a partir de un modelo lineal mixto general mientras se controla la edad, la duración de la enfermedad y el género.
Suplemento Tabla 7-1 | Los cambios de peso, IMC, insulina, IRI y LDL-C por paciente durante el periodo de tratamiento en los diferentes grupos.
Suplemento Tabla 7-2 | Estimaciones de los efectos del apetito sobre el aumento de peso y las medidas de resultado relacionadas con el metabolismo.
Abreviaturas
As, Antipsicóticos de segunda generación; ECA, Ensayo clínico aleatorizado; CAFÉ, Comparación de atípicos para el primer episodio; CATIE, Ensayos clínicos antipsicóticos en la eficacia de la intervención; DSM-5, Manual diagnóstico y estadístico de los trastornos mentales-quinta edición; ECG: Electrocardiograma; PANSS: Escala de Síndrome Positivo y Negativo; TESS: Escala de Síntomas Emergentes del Tratamiento; ELISA: Ensayos de inmunoabsorción ligados a enzimas; IMC: Índice de masa corporal; HDL-C: Lipoproteína de alta densidad; LDL-C: Lipoproteína de baja densidad.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsychotic-induced weight gain: a comprehensive research synthesis. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Diagnostic and statistical manual of mental disorders (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). Niveles de grelina, colecistoquinina, visfatina, leptina y proteínas relacionadas con el agutí durante el tratamiento de 6 semanas con olanzapina en pacientes masculinos con psicosis en primer episodio. Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). El papel potencial del apetito en la predicción de los cambios de peso durante el tratamiento con olanzapina. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsychotic drug-induced weight gain: development of an animal model. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Cardiometabolic risk of second-generation antipsychotic medications during first-time use in children and adolescents. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Fármacos antipsicóticos y obesidad. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). Las bases celulares y moleculares de la resistencia a la leptina y la grelina en la obesidad. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). La grasa alta induce la inflamación aguda y crónica en el hipotálamo: efecto de la dieta alta en grasas, el palmitato y el TNF-alfa en las neuronas NPY que regulan el apetito. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Etnicidad y exceso de mortalidad en enfermedades mentales graves: un estudio de cohorte. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Exceso de mortalidad en las enfermedades mentales graves: estudio de cohorte de 10 años basado en la población en las zonas rurales de Etiopía. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Aumento de la ingesta de alimentos y del gasto energético tras la administración de olanzapina a hombres sanos. Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
Asociación G.A.o.t.W.M. (2013). Declaración de Helsinki de la Asociación Médica Mundial: principios éticos para la investigación médica en seres humanos. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Weight gain associated with increased food intake and low habitual activity levels in male adolescent schizophrenic inpatients treated with olanzapine. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Mecanismos fisiopatológicos del aumento del riesgo cardiometabólico en personas con esquizofrenia y otras enfermedades mentales graves. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). La olanzapina reduce la actividad física en ratas expuestas a la anorexia basada en la actividad: ¿posibles implicaciones para el tratamiento de la anorexia nerviosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Nuevas directrices y evidencia para la prevención y el tratamiento de la dislipidemia y la enfermedad cardiovascular aterosclerótica en China. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Eficacia y tolerabilidad comparativas de 32 antipsicóticos orales para el tratamiento agudo de adultos con esquizofrenia multiepisódica: una revisión sistemática y un metaanálisis en red. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). Un estudio piloto controlado con placebo de olanzapina adyuvante para adolescentes con anorexia nerviosa. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Métodos en la obesidad. Conn «s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapine and olanzapine are associated with food craving and binge eating: results from a randomized double-blind study. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). La asociación del péptido apetitivo ghrelina acetilada con el craving de alcohol en individuos con abstinencia temprana de alcohol. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Eficacia comparativa y tolerabilidad de 15 fármacos antipsicóticos en la esquizofrenia: un meta-análisis de tratamientos múltiples. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Efectos de las dietas altas en fructosa sobre la señalización central del apetito y la función cognitiva. Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Efectos diferenciales de la olanzapina y la clozapina en los niveles plasmáticos de adipocitoquinas y grelina total. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Los cambios en las hormonas reguladoras del apetito después de la ingesta de alimentos están asociados con los cambios en el apetito reportado y una medida de la alimentación hedónica en niñas y mujeres jóvenes con anorexia nerviosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Efficacy and tolerability of olanzapine, quetiapine, and risperidone in the treatment of early psychosis: a randomized, double-blind 52-week comparison. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olanzapine increases plasma ghrelin level in patients with schizophrenia. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Riesgo médico en pacientes con trastorno bipolar y esquizofrenia. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Actividad de recompensa estriatal y cambio de peso asociado a los antipsicóticos en pacientes con esquizofrenia en tratamiento inicial. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Investigación del mecanismo de aumento del apetito después de la olanzapina por sLORETA durante el sueño. Biol. Psychiatry 83, S441-S442.
Google Scholar
Pérez-Cruzado, D., Cuesta-Vargas, A., Vera-García, E., Mayoral-Cleries, F. (2018). Medicación y actividad física y aptitud física en la enfermedad mental grave. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Efecto atenuante de la reboxetina sobre el apetito y el aumento de peso en pacientes con esquizofrenia tratados con olanzapina: un estudio doble ciego controlado con placebo. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). A comparison of the effects of olanzapine and risperidone versus placebo on eating behaviors. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Leptin and ghrelin levels in patients with schizophrenia during different antipsychotics treatment: a review. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Cambios neuronales asociados al procesamiento de la información sobre el apetito en pacientes esquizofrénicos tras 16 semanas de tratamiento con olanzapina. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Función supresora del apetito de las neuronas glutamatérgicas del septo medial. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Clinical research of Olanzapine for prevention of chemotherapy-induced nausea and vomiting. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Lifestyle intervention and metformin for treatment of antipsychotic-induced weight gain: a randomized controlled trial. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Tratamiento con metformina de la dislipidemia inducida por antipsicóticos: un análisis de dos ensayos aleatorios controlados con placebo. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar
.




