Fronteras en Neurociencia
Introducción
La generación de nuevas neuronas en el hipocampo adulto, una región del cerebro implicada en la navegación espacial y la formación de la memoria (Buzsaki y Moser, 2013), es una llamativa forma de plasticidad que persiste a lo largo de la vida en varias especies, incluida la humana (Altman y Das, 1965; Eriksson et al, 1998; Moreno-Jiménez et al., 2019). Entre las muchas condiciones que regulan la neurogénesis hipocampal adulta, uno de los procesos más fiables y ampliamente descritos es la disminución de la producción neuronal mediada por la edad, mientras que las poblaciones neuronales preexistentes permanecen constantes con el envejecimiento normal (Kuhn et al., 1996; Kempermann et al., 1998; Burke y Barnes, 2010). El envejecimiento afecta a muchas funciones del cerebro, como la transmisión sináptica y la plasticidad, que se cree que contribuyen a la pérdida de memoria (Burke y Barnes, 2006; Fan et al., 2017). Dado que el hipocampo es particularmente vulnerable a las alteraciones relacionadas con la edad y la neurodegeneración, encontrar estrategias para mejorar la plasticidad en esta estructura se vuelve relevante para prevenir o aliviar los efectos de la senescencia (Bartsch y Wulff, 2015). El ejercicio físico y los estímulos cognitivos mejoran la salud del cerebro y tienden a mejorar los efectos del envejecimiento. Uno de los beneficios directos puede surgir del aumento dependiente de la actividad de los niveles del factor neurotrófico derivado del cerebro (BDNF), que ha demostrado restaurar la plasticidad sináptica, aumentar la neurogénesis y mejorar el aprendizaje en ratones de mediana edad (Marlatt et al., 2012; Trinchero et al., 2017). El ejercicio también reduce la activación de la microglía, aumenta la plasticidad sináptica dependiente de la actividad, la proliferación de células progenitoras neurales y acelera el desarrollo y la integración de las células granulares (GC) nacidas en la edad adulta en el hipocampo envejecido (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Estos efectos contribuyen a restaurar la plasticidad dependiente del hipocampo y se correlacionan con el comportamiento adaptativo. Así, los animales envejecidos que rinden mal en tareas de aprendizaje espacial y separación de patrones, mejoran su rendimiento tras el ejercicio (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
La medida en que la neurogénesis contribuye a los efectos conductuales positivos del ejercicio en los animales envejecidos sigue siendo objeto de estudio. Es posible que el aumento de la tasa de neurogénesis ejercida por el ejercicio físico contribuya a la mejora del comportamiento. Pero también pueden estar implicados otros mecanismos (Meshi et al., 2006). La integración acelerada de nuevas neuronas en el giro dentado envejecido tras el ejercicio, que modifica la calidad de los nuevos GC, puede contribuir también a la mejora conductual. Mientras que las neuronas nacidas en ratones de mediana edad se desarrollan lentamente, el ejercicio voluntario sostenido promueve el crecimiento dendrítico, la formación de espinas y la integración neuronal (Trinchero et al., 2017). Se observaron efectos similares con exposiciones breves al enriquecimiento ambiental (EE) (Trinchero et al., 2019). Si se acumula en múltiples cohortes neuronales, la integración neuronal acelerada desencadenada por el ejercicio podría ejercer una influencia significativa en el aprendizaje y el comportamiento dependientes del hipocampo. En este trabajo demostramos que varias cohortes de nuevos GC pueden integrarse rápidamente en los circuitos preexistentes de los ratones que continúan participando en la carrera voluntaria, y que estos efectos persisten una vez que los ratones han dejado de correr.
Materiales y Métodos
Ratones y Cirugía
Los ratones macho C57BL/6J fueron alojados en 4-5 animales por jaula en condiciones estándar. Se seleccionaron ratones de ocho meses (8M) porque, más allá de esta edad, se produce un fuerte declive en la neurogénesis del hipocampo que impide el estudio de las neuronas etiquetadas (Morgenstern et al., 2008; Trinchero et al., 2017). Los ratones fueron anestesiados (150 μg de ketamina/15 μg de xilacina en 10 μl de solución salina/g), y se infundió retrovirus en la región septal del giro dentado derecho (1,5 μl a 0,15 μl/min) utilizando pipetas microcapilares calibradas estériles mediante cirugía estereotáxica; coordenadas desde el bregma (en mm): -2 anteroposterior, -1,5 lateral y -1,9 ventral. En los momentos indicados, se fijaron los cerebros y se prepararon secciones para la obtención de imágenes confocales (Trinchero et al., 2017). Solo se incluyeron en el análisis los GC de la circunvolución dentada septal, correspondientes a secciones localizadas desde -0,96 a -2,30 mm desde el bregma, según el atlas del cerebro del ratón (Paxinos y Franklin, 2001). Los protocolos experimentales fueron aprobados por el Comité Institucional para el Cuidado y Uso de Animales de la Fundación Instituto Leloir, de acuerdo con los Principios para la Investigación Biomédica con Animales del Consejo de Organizaciones Internacionales para las Ciencias Médicas y las disposiciones establecidas en la Guía para el Cuidado y Uso de Animales de Laboratorio.
Correr
Las distancias de carrera se registraron para cada experimento utilizando ruedas de correr inalámbricas. En los experimentos de la Figura 1 los animales fueron alojados con una rueda de correr durante 7 o 21 días, según se indica. En esta condición los ratones corrieron ∼2 km/día. En las figuras 2 y 3, en las que los ratones corrieron durante 1, 2 ó 3 meses, la distancia controlada fue de ∼10 km/día.
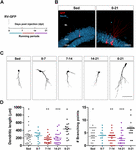
Figura 1. Períodos largos, pero no cortos, de carrera aceleran la maduración morfológica de los nuevos GC. (A) Diseño experimental. La inyección de RV-GFP fue seguida por la exposición a 1 semana de carrera voluntaria en las ventanas indicadas o durante todo el experimento (0-21 dpi). (B) Imágenes representativas de los GC de 21 dpi que expresan GFP (rojo) tomadas de los grupos sedentarios y de 0-21 corriendo. NeuN (azul) marca la capa de células granulares (GCL) (ML, capa molecular). Barra de escala, 50 μm. (C) Imágenes confocales representativas de 21-dpi GFP-GCs para los diferentes grupos. Barra de escala, 50 μm. (D) Complejidad dendrítica (longitud y puntos de ramificación) para las diferentes ventanas de funcionamiento. ∗, ∗∗, y ∗∗∗ denotan p < 0,05, p < 0,01, y p < 0,001 en comparación con el grupo que corre 0-21 después de la prueba de Kruskal-Wallis seguida de la prueba post hoc de Dunn. No se encontraron diferencias entre ninguno de los grupos que corrieron durante 7 días. Tamaño de las muestras (neuronas/ratones): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) y 15/3 (0-21). Las barras horizontales indican la media ± SEM. Los círculos abiertos corresponden a neuronas de ejemplo.
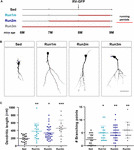
Figura 2. Efectos de la carrera en diferentes cohortes neuronales. (A) Diseño experimental. La inyección de RV-GFP fue seguida por 3 semanas de carrera y precedida por condiciones sedentarias (Run1m), 1 (Run2m), o 2 meses de carrera (Run3m). Todos los grupos se compararon con ratones sedentarios (Sed). La longitud dendrítica total se analizó a los 21 dpi. (B) Imágenes confocales representativas GFP-GCs. Barra de escala, 50 μm. (C) Complejidad dendrítica (longitud y puntos de ramificación) para las diferentes ventanas de marcha. ∗, ∗∗, y ∗∗∗ denotan p < 0,05, p < 0,01, y p < 0,001 en comparación con Sed tras la prueba de Kruskal-Wallis seguida de la prueba post hoc de Dunn. Tamaño de las muestras (neuronas/ratones): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) y 15/3 (Run3m). Las barras horizontales indican la media ± SEM. Los círculos abiertos corresponden a neuronas de ejemplo.

Figura 3. Efectos persistentes del ejercicio crónico. (A) Diseño experimental. La inyección de RV-GFP fue seguida por 3 semanas de carrera (Run1m) o precedida por 1 mes de ejercicio (Run-1m) o 1 mes de ejercicio y 1 mes sin la rueda de correr (Run-2m). Todos los grupos se compararon con ratones sedentarios (Sed). La longitud dendrítica total se analizó a los 21 dpi. (B) Imágenes confocales representativas de los GC etiquetados. Barra de escala, 50 μm. (C) Complejidad dendrítica (longitud y puntos de ramificación) para las diferentes ventanas de funcionamiento. ∗∗∗ denota p < 0,001 en comparación con Sed tras la prueba de Kruskal-Wallis seguida de la prueba post hoc de Dunn. Tamaños de las muestras (neuronas/ratones): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) y 18/3 (Run-2m). (D) Se analizó la morfología del BMF en CA3 para los grupos Run1m y Run-1m y se comparó con Sed. Imágenes confocales representativas. Barra de escala, 5 μm. (E) ∗ y ∗∗ denotan p < 0,05 y p < 0,01 tras la prueba de Kruskal-Wallis seguida de la prueba post hoc de Dunn. Tamaños de las muestras: 27/4 (Sed), 32/4 (Run1m) y 18/4 (Run-1m). Las barras horizontales indican la media ± SEM. Los círculos abiertos corresponden a boutons de ejemplo.
Inmunofluorescencia
La inmunotinción se realizó en secciones coronales de 60-μm de flotación libre. Los anticuerpos se aplicaron en solución salina tamponada con tris (TBS) con 3% de suero de burro y 0,25% de Tritón X-100. La inmunofluorescencia se realizó utilizando anticuerpos anti GFP (policlonal de conejo; 1:500; Invitrogen), anti NeuN (monoclonal de ratón; 1:50; regalo de F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Estados Unidos), anticuerpos anti-conejo Cy3 y anti-ratón Cy5 de burro (1:250; Jackson Immuno Research Laboratories).
Microscopía confocal
Para las mediciones de la longitud dendrítica, se adquirieron imágenes (40×; NA 1,3; inmersión en aceite) de secciones de 60-μm de grosor tomando pilas Z que incluían 35-50 cortes ópticos, unidad airy = 1 a intervalos de 0,8-μm (Trinchero et al, 2017). A continuación, se midió la longitud dendrítica utilizando el software LSM Image Browser a partir de las proyecciones de las reconstrucciones tridimensionales en un solo plano en los GC que expresaban GFP. Las imágenes de los MFB marcados con GFP en la región CA3 se adquirieron a intervalos de 0,4μm (63×; NA 1,4; inmersión en aceite) y un zoom digital de 6. El área y el número de filopodios se analizaron a partir de las proyecciones de las reconstrucciones tridimensionales en un solo plano. Se seleccionaron para su cuantificación las boutons de fibras musgosas (MFB) que cumplían los siguientes criterios (i) el diámetro de la bouton era >tres veces mayor que el diámetro de la fibra, (ii) la bouton estaba conectada a la fibra musgosa en al menos un extremo (Toni et al., 2008). Los filopodios se identificaron como protuberancias que surgían de grandes terminales musgosas (1 μm < longitud < 20 μm) (Acsady et al., 1998). Las extensiones filopodiales se midieron contando el número de protuberancias por terminal. Para la captura de imágenes y el análisis de las propiedades morfológicas, todos los grupos experimentales en estudio fueron ciegos para el operador.
Análisis estadístico
A menos que se especifique lo contrario, los datos se presentan como media ± SEM. La normalidad se evaluó mediante la prueba de Shapiro-Wilks, la prueba ómnibus de D’Agostino-Pearson y la prueba de Kolmogorov-Smirnov, con un valor p de 0,05. Cuando los datos cumplían las pruebas de normalidad (distribución gaussiana e igual varianza), se utilizó la prueba t no apareada con la corrección de Welch o el ANOVA con la prueba post hoc de Bonferroni, según lo indicado. En los casos que no cumplían la normalidad, se utilizaron pruebas no paramétricas como las siguientes: Prueba de Mann-Whitney para comparaciones independientes, y prueba de Kruskal-Wallis para comparaciones múltiples.
Resultados
Previamente hemos demostrado que correr acelera el desarrollo y la integración funcional de nuevos GC en el hipocampo envejecido (Trinchero et al., 2017). Ahora investigamos si este tipo de plasticidad exige un nivel persistente de actividad que se acumula en el tiempo, o si períodos más cortos de correr también pueden desencadenar una integración más rápida, como se observó previamente para la exposición a EE (Trinchero et al., 2019). Para abordar esta cuestión, se etiquetaron nuevas cohortes neuronales en ratones de mediana edad (8 meses de edad; 8M) utilizando un retrovirus que expresa GFP (RV-GFP). A los ratones se les permitió utilizar una rueda para correr durante 1 semana dentro de diferentes ventanas de desarrollo neuronal, o correr durante todo el intervalo de crecimiento neuronal (3 semanas; Figuras 1A,B). Como se ha descrito anteriormente, los nuevos GC mostraron un desarrollo lento en los ratones sedentarios, lo que dio lugar a dendritas cortas con pocas ramificaciones a las 3 semanas. Correr durante una semana no cambió el aspecto general de los nuevos GC en ninguno de los intervalos probados (Figuras 1C,D). Por el contrario, correr durante todo el intervalo de 3 semanas dio lugar a un aumento de la longitud de las dendritas y de las ramificaciones, lo que es coherente con una integración neuronal acelerada.
Los efectos observados del ejercicio se probaron en una sola cohorte neuronal, la que fue etiquetada retroviralmente. Sin embargo, dado que continuamente se generan nuevos GC, es concebible que los GC nacidos en diferentes momentos dentro del periodo de ejercicio también puedan verse influidos por la actividad. Para probar esta hipótesis, utilizamos una estrategia sencilla para etiquetar cohortes neuronales nacidas en diferentes momentos con respecto al inicio del ejercicio, exponiendo a los ratones a ruedas de correr durante diferentes intervalos, pero analizando siempre la estructura neuronal 3 semanas después de la inyección retroviral (denominada 1m para simplificar). Así, se compararon tres cohortes: una que corrió durante 3 semanas, etiquetada justo al inicio del ejercicio (Run1m), otra que corrió durante 2 meses, etiquetada 1 mes después del inicio del ejercicio (Run2m), y otra que corrió 3 meses, etiquetada 2 meses después del inicio del ejercicio (Run3m) (Figura 2A). Observamos un grado similar de crecimiento neuronal en todas las condiciones en comparación con los ratones sedentarios, lo que indica que todas las cohortes neuronales nacidas en el cerebro de un ratón de mediana edad que realiza carreras voluntarias experimentarán un rápido crecimiento e integración (Figuras 2B,C). Los árboles dendríticos de los GC de los ratones Run3m eran ligeramente más largos que los de los ratones Run1m o Run2m, lo que sugiere que la promoción de la integración neuronal podría responder a un mecanismo cuyo efecto se acumula en el tiempo. Sin embargo, 1 mes de carrera dio lugar a un efecto casi máximo en el desarrollo del CG.
A continuación, investigamos los efectos del ejercicio en el cerebro envejecido sobre las cohortes neuronales nacidas una vez finalizada la actividad. Comparamos cómo el hecho de correr durante 3-4 semanas influye en el desarrollo de nuevos GCs nacidos justo al inicio (Run1m), al final (Run-1m), o 1 mes después del final del ejercicio (Run-2m; Figura 3A). Sorprendentemente, las cohortes neuronales nacidas al principio o al final del periodo de carrera respondieron de forma similar (Figuras 3B,C). Por el contrario, las cohortes nacidas 1 mes después del final del ejercicio (Run-2m) sólo mostraron un efecto sutil.
Para integrarse plenamente en el circuito, las GC establecen conexiones excitatorias glutamatérgicas sobre las células piramidales de CA3 a través de grandes MFBs, y reclutan la inhibición feedforward GABAérgica sobre las células piramidales a través de extensiones filopodiales que surgen de esos terminales (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Mientras que el análisis confocal no reveló cambios en el área de los MFBs de las neuronas nacidas en Run-1m o Run1m en comparación con los controles, el número de filopodios/MFBs aumentó en ∼100% (Figuras 3D,E). Estos resultados indican que el ejercicio físico aumenta específicamente la conectividad de los nuevos GCs en la red local inhibitoria (Trinchero et al., 2019).
Discusión
La neurogénesis adulta implica una secuencia de pasos complejos de desarrollo que da lugar a la integración de nuevas unidades de procesamiento de información. Las células madre neurales de la zona subgranular abandonan su estado quiescente para convertirse en células progenitoras neurales proliferantes que amplían la población precursora (células amplificadoras del tránsito) (Bonaguidi et al., 2012). Las células progenitoras generan neuronas que migran, se desarrollan y se integran en el circuito. Durante esta prolongada ventana temporal se produce una marcada reducción del pool neuronal debido a la muerte celular apoptótica. El ejercicio voluntario y la EE constituyen fuertes estímulos para impulsar la neurogénesis del hipocampo adulto en roedores a lo largo de la vida (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). La neurogénesis disminuye en el cerebro que envejece, principalmente como consecuencia de la reducción del tamaño del conjunto de células progenitoras. Tanto el correr como la EE pueden contrarrestar la disminución de la producción neuronal registrada en los animales que envejecen, actuando a través de diferentes mecanismos (Kempermann et al., 2010). Correr actúa a dos niveles para potenciar la neurogénesis: aumentando la tasa de proliferación de las células progenitoras neurales (van Praag et al., 1999b, 2005; Cooper et al., 2018), y acelerando la maduración e integración funcional de las neuronas en desarrollo (Trinchero et al., 2017). La EE aumenta la supervivencia y también acelera la maduración de los nuevos GC, pero no influye en la proliferación (Trinchero et al., 2017, 2019).
La carrera también promueve el recableado de la conectividad neuronal y la modulación de las propiedades intrínsecas en los nuevos GC durante la primera semana de desarrollo en ratones jóvenes-adultos (Sah et al., 2017). Recientemente hemos informado de un periodo crítico durante la segunda semana de maduración de los GCs en animales envejecidos, en el que la EE induce el crecimiento dendrítico y una integración más rápida de las nuevas neuronas en el circuito (Trinchero et al., 2019). Nos preguntamos aquí si correr durante 1 semana en cualquier momento del desarrollo de los GCs afectaría a su integración, pero no encontramos ningún efecto (Figura 1). Se requirió el periodo completo de 3 semanas de carrera para regular la neurogénesis. La falta de modulación a corto plazo sugiere un mecanismo mediado por factores que necesitan acumularse para ejercer cambios notables. Curiosamente, el ejercicio voluntario exacerba la producción de BDNF, que se acumula durante semanas antes de alcanzar un nivel de meseta que ejerce acciones máximas (Vecchio et al., 2018). Aunque las neurotrofinas son mediadores clave, es plausible que los efectos observados aquí estén mediados por múltiples mecanismos. El ejercicio también potencia la actividad eléctrica en el giro dentado, aumenta el flujo sanguíneo y modula la neuroinflamación (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). La contribución de otros mecanismos requiere más estudios.
Aquí mostramos que los GC de ∼3 semanas de edad de ratones envejecidos expuestos crónicamente a una rueda de correr (hasta 3 meses) presentan un fenotipo completamente desarrollado con arborizaciones dendríticas largas y complejas, similares a las de los nuevos GC generados en ratones adultos jóvenes (Figura 2). Los GCs maduros en ratones jóvenes-adultos y de mediana edad alcanzan longitudes y complejidades dendríticas equivalentes al final del desarrollo, comparables a los GCs de 3 semanas de edad en ratones envejecidos expuestos a EE o a correr (Piatti et al., 2011; Trinchero et al., 2017, 2019). Esta evidencia acumulada habla de una clara aceleración en la velocidad de maduración evocada por la carrera.
A nivel de la producción neuronal, la carrera promovió el rápido crecimiento de las extensiones filopodiales pero no modificó el tamaño de los CGs (Figuras 3D,E). Este resultado sugiere que los nuevos GCs se integran rápidamente, pero su salida podría estar sesgada hacia la activación de interneuronas GABAérgicas en CA3 (contactadas por filopodios), en lugar de células piramidales contactadas por MFBs (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Es sorprendente que la EE provocara un marcado aumento tanto del tamaño de los MFB como del número de extensiones filopodiales en los ratones que envejecen, lo que es coherente con una modulación más equilibrada de la producción neuronal (Trinchero et al., 2019). Especulamos que los cambios debidos a la EE implican una remodelación dependiente de la actividad de sinapsis específicas que se fortalecen para codificar señales espaciales (Nicoll y Schmitz, 2005; Holtmaat y Svoboda, 2009). Por el contrario, correr puede representar un estímulo general para que los nuevos CGs se preparen para conectarse a objetivos específicos cuando la codificación sea necesaria, conservando al mismo tiempo el tono inhibitorio de las interneuronas GABAérgicas que podría actuar como un mecanismo que limita la actividad postsináptica hasta que el nuevo CG se haya ensamblado adecuadamente dentro de la red circundante.
Nuestros resultados indican que el cerebro que envejece genera señales neurogénicas cuando los ratones continúan corriendo durante períodos prolongados (meses). En este contexto, las siguientes cohortes neuronales nacidas en los ratones que corren se desarrollarán e integrarán rápidamente, permitiendo que los circuitos de envejecimiento acumulen un número sustancial de nuevas neuronas (Figura 4). La incorporación continua de nuevos GC con características que se asemejan a lo que ocurre en ratones más jóvenes da lugar a un hipocampo rejuvenecido con neuronas que podrían estar preparadas para responder a futuras experiencias.
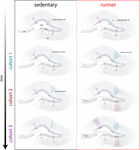
Figura 4. Rejuvenecimiento de la red del hipocampo inducido por la carrera en ratones de mediana edad. Representación esquemática del curso temporal de la integración neuronal en ratones sedentarios (izquierda) y corredores (derecha) tras intervalos prolongados de ejercicio voluntario. En la zona subgranular de la circunvolución dentada, las células similares a la glía radial (RGL) permanecen en estado quiescente (arriba). Los ratones sedentarios que envejecen presentan bajas tasas de neurogénesis y las nuevas neuronas se desarrollan de forma lenta (las cohortes representativas se indican con colores diferentes). En los ratones que corren, se potencia la producción de nuevos GC, y estas nuevas unidades se desarrollan e integran más rápidamente, ampliando la red neuronal de forma acumulativa durante un largo periodo de tiempo. En última instancia, estas nuevas cohortes de neuronas plenamente maduras se comprometen a procesar información a demanda.
Desde una perspectiva más amplia, el aumento de la longevidad asociado a la sociedad moderna va acompañado de un mayor riesgo de deterioro cognitivo. Por ello, resulta relevante comprender los mecanismos que subyacen a los conocidos beneficios del ejercicio en la función cerebral. Además, podrían existir diferencias a largo plazo entre los individuos que practican ejercicio durante diferentes intervalos de la vida y los que lo han realizado de forma continua, en cuanto a la disminución del riesgo de desarrollar enfermedades neurodegenerativas (Llorens-Martin, 2018). Nuestros resultados demuestran que la carrera continua promueve la integración de muchas cohortes neuronales, elevando así la complejidad de la red de manera notable. El diseño de diferentes estrategias para aumentar la eficacia de la integración de nuevas neuronas en el hipocampo podría servir como un mecanismo prometedor de plasticidad para eventualmente mejorar el declive cognitivo que se produce en el cerebro envejecido sano y enfermo. Por último, la disección de los mecanismos que subyacen a los diferentes aspectos de dicha integración y desarrollo neuronal acelerados nos enseñará mucho sobre el potencial de plasticidad de las redes neuronales en el cerebro que envejece.
Disponibilidad de los datos
Los datos que apoyan los hallazgos de este estudio están disponibles en el autor correspondiente previa solicitud razonable.
Declaración ética
El estudio con animales fue revisado y aprobado por el comité para el uso y cuidado de animales de laboratorio del Instituto Leloir.
Contribuciones de los autores
MT y MH realizaron los experimentos y analizaron los datos. MT, MH y AS diseñaron los experimentos y redactaron el manuscrito. AS proporcionó apoyo financiero.
Financiación
Este trabajo fue apoyado por la Agencia Argentina de Promoción Científica y Tecnológica (Grant# PICT2015-3814), el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares, y el Centro Internacional Fogarty (Grant# R01NS103758) a AS, quien es investigador en el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT recibió el apoyo de una beca del CONICET.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Agradecemos a los miembros del laboratorio de AS por sus perspicaces discusiones.
Acsady, L., Kamondi, A., Sik, A., Freund, T., y Buzsaki, G. (1998). GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., y Das, G. D. (1965). Evidencia autoradiográfica e histológica de la neurogénesis hipocampal postnatal en ratas. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., y Wulff, P. (2015). El hipocampo en el envejecimiento y la enfermedad: de la plasticidad a la vulnerabilidad. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., y Song, H. (2012). Una hipótesis unificadora sobre las propiedades de las células madre neurales de los mamíferos en el hipocampo adulto. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., y Barnes, C. A. (2006). Plasticidad neuronal en el cerebro que envejece. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., y Barnes, C. A. (2010). Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., y Moser, E. I. (2013). Memoria, navegación y ritmo theta en el sistema hipocampal-entorrinal. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., y van Praag, H. (2018). A la carrera por la plasticidad del hipocampo. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., y Sendtner, M. (2016). Puede el ejercicio físico en la vejez mejorar la memoria y la función del hipocampo? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenesis in the adult human hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., y Villeda, S. A. (2017). Mecanismos de envejecimiento del hipocampo y el potencial de rejuvenecimiento. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., y Toni, N. (2013). La neurogénesis del hipocampo adulto se correlaciona inversamente con la microglía en condiciones de carrera voluntaria y envejecimiento. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., y Svoboda, K. (2009). Plasticidad sináptica estructural dependiente de la experiencia en el cerebro de los mamíferos. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Correr reduce el estrés y mejora la génesis celular en ratones envejecidos. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Por qué y cómo la actividad física promueve la plasticidad cerebral inducida por la experiencia. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., y Gage, F. H. (1998). Experience-induced neurogenesis in the senescent dentate gyrus. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., y Kempermann, G. (2006). El ejercicio físico previene el declive relacionado con la edad de la actividad de las células precursoras en el giro dentado del ratón. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Las subpoblaciones de células proliferantes del hipocampo adulto responden de forma diferente a los estímulos neurogénicos fisiológicos. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., y Gage, F. H. (1996). Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Ejercitar nuevas neuronas para vencer la enfermedad de Alzheimer. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Correr a lo largo de la mediana edad mejora la función de la memoria, la neurogénesis del hipocampo y los niveles de BDNF en ratones C57BL/6J hembra. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). La neurogénesis del hipocampo no es necesaria para los efectos conductuales del enriquecimiento ambiental. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). La neurogénesis hipocampal adulta es abundante en sujetos neurológicamente sanos y desciende bruscamente en pacientes con enfermedad de Alzheimer. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., y Schinder, A. F. (2008). Newborn granule cells in the ageing dentate gyrus. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., y Schmitz, D. (2005). Plasticidad sináptica en las sinapsis de las fibras musgosas del hipocampo. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., y Kelly, A. M. (2009). La exposición a largo plazo a la cinta de correr protege contra los cambios neurodegenerativos relacionados con la edad en el hipocampo de la rata. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., y Franklin, K. B. J. (2001). The Mouse Brain in Stereotaxic Coordinates. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., y Schinder, A. F. (2011). El momento de la maduración neuronal en el hipocampo adulto está modulado por la actividad de la red local. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., y Frankland, P. W. (2015). Desarrollo de la conectividad celular generada por el adulto con poblaciones celulares excitatorias e inhibitorias en el hipocampo. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., y van Praag, H. (2017). Correr reorganiza el circuito de las neuronas del hipocampo nacidas en la edad adulta de una semana. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., y Ormerod, B. K. (2013). El ejercicio diario mejora la memoria, estimula la neurogénesis del hipocampo y modula las citoquinas inmunes y neuroinmunes en ratas que envejecen. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Seamless reconstruction of intact adult-born neurons by serial end-block imaging reveals complex axonal guidance and development in the adult hippocampus. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Las neuronas nacidas en el giro dentado adulto forman sinapsis funcionales con las células objetivo. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzón Salinas, M. C., et al. (2017). Alta plasticidad de nuevas células granulares en el hipocampo envejecido. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzón-Salinas, M. C., y Schinder, A. F. (2019). Plasticidad estructural dependiente de la experiencia de las neuronas nacidas en el adulto en el hipocampo envejecido. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., y Gage, F. H. (1999a). Correr mejora la neurogénesis, el aprendizaje y la potenciación a largo plazo en ratones. Proc. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., y Gage, F. H. (1999b). Correr aumenta la proliferación celular y la neurogénesis en el giro dentado del ratón adulto. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., y Gage, F. H. (2005). Exercise enhances learning and hippocampal neurogenesis in aged mice. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., y Aubert, I. (2018). Los efectos neuroprotectores del ejercicio: mantener un cerebro sano a lo largo del envejecimiento. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). El ejercicio aumenta la proliferación de las células madre neurales y el crecimiento de las neuritas y la supervivencia de las células progenitoras neuronales en el giro dentado de ratones de mediana edad. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., y Hen, R. (2015). Correr rescata un déficit de discriminación contextual basado en el miedo en ratones envejecidos. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). La mejora de la memoria inducida por la carrera se correlaciona con la preservación de espinas delgadas en el área CA1 del hipocampo de ratones C57BL/6 viejos. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.




