Fronteras en Oncología
Introducción
El glioblastoma y el astrocitoma anaplásico (ANA) son dos de los tumores cerebrales primarios más frecuentes en adultos (1). Existe un verdadero aumento de las tasas de incidencia, especialmente en los ancianos (1-3). En la práctica clínica, es difícil diferenciar a los pacientes con glioblastoma de aquellos con ANA antes de la cirugía o la biopsia, porque los síntomas y signos de ambos tumores son relativamente uniformes e inespecíficos (4, 5). Sin embargo, el manejo para ellos es diferente, como el protocolo de quimioterapia, la dosis y el modo de administración (6). Por ejemplo, para los pacientes con ANA (grado III de la OMS), se recomienda recibir radioterapia o TMZ tras la resección o la biopsia; mientras que para los pacientes recién diagnosticados de glioblastoma (grado IV de la OMS), se trata de radioterapia más TMZ concurrente, seguida de TMZ adyuvante. Según estudios anteriores, el glioblastoma y el ANA crecen por invasión en el tejido cerebral normal, se propagan a través del líquido cefalorraquídeo (LCR) y se extienden más allá de la distribución de una sola arteria carótida o vertebral, por lo que ambos tienen una mala respuesta al tratamiento médico y se convierten en las principales causas de muerte relacionadas con el cáncer en adultos (7, 8). Además, el pronóstico del glioblastoma y del ANA es diferente. En la población de edad avanzada, no hay una diferencia significativa en el pronóstico entre el glioblastoma y el ANA, pero la diferencia puede existir en la población más joven (9). Por lo tanto, es difícil pero crucial distinguir el glioblastoma del ANA.
La Resonancia Magnética (RM) es la neuroimagen óptima en el diagnóstico preoperatorio del glioblastoma y el ANA por su capacidad multiplanar y su contraste superior de tejidos blandos. Aunque algunos estudios demostraron que la presencia de realce anular y necrosis era sugestiva de glioblastoma, en la mayoría de los casos, tanto el glioblastoma como el ANA aparecen como formas irregulares en las imágenes de RM (hiperdensas en la secuencia ponderada en T2 e hipodensas en la secuencia ponderada en T1) con diversos grados de realce de contraste basado en Gd y edema, de los cuales las diferencias eran generalmente imperceptibles para el ojo humano (10-12).
Recientemente, el análisis de textura (AT), también conocido como radiómica, se ha aplicado ampliamente en diferentes campos. Los investigadores descubrieron que el AT era un método factible y prometedor para facilitar el diagnóstico diferencial, ya que permitía adquirir información cuantitativa adicional de las imágenes de RM que era invisible para la evaluación humana (13-15). La AT describe la distribución de frecuencias y la organización espacial del valor de los vóxeles para revelar las posibles diferencias en el tejido tumoral (16). Estudios anteriores han explorado la viabilidad de la aplicación de la AT en el diagnóstico diferencial, la clasificación de subtipos de tumores y la detección de la heterogeneidad del tejido tumoral (17-19). A nuestro entender, la aplicación de la AT en el diagnóstico diferencial entre el glioblastoma y el ANA no se ha comunicado todavía. El propósito de este estudio fue evaluar la capacidad discriminativa del análisis de la textura de la resonancia magnética utilizando algoritmos de aprendizaje automático para diferenciar el glioblastoma y el ANA.
Materiales y métodos
Selección de pacientes
Buscamos retrospectivamente en la base de datos de nuestra institución y seleccionamos a todos los pacientes diagnosticados histopatológicamente como glioblastoma o ANA, desde enero de 2015 hasta diciembre de 2018. Los criterios de elegibilidad para los pacientes calificados fueron: (1) diagnóstico histopatológico concluyente de glioblastoma o ANA; (2) historias clínicas electrónicas elaboradas, especialmente material patológico; (3) RMN diagnóstica en nuestra institución antes de la resección quirúrgica. Los criterios de exclusión fueron: (1) antecedentes de enfermedad intracraneal (por ejemplo, traumatismo cerebral, infección intracraneal u otros tipos de tumor cerebral), teniendo en cuenta la interferencia del tejido cicatricial en la intensidad de las imágenes; (2) presencia de artefacto de movimiento en la RM; (3) antecedentes de tratamientos antes de la RM (por ejemplo, cirugía, quimioterapia o radioterapia); (4) pacientes que no alcanzaban los criterios de diagnóstico de glioblastoma o ANA según el sistema de clasificación de la OMS de 2016. Un neuropatólogo senior con 10 años de experiencia juzgó si el paciente cumplía los criterios (el sistema de clasificación de la OMS de 2016) de glioblastoma o ANA. La junta de revisión institucional aprobó este estudio retrospectivo. Se obtuvo el consentimiento informado por escrito de los participantes inscritos en este estudio. El Comité de Ética de la Universidad de Sichuan y el departamento de radiología de nuestra institución han aprobado la utilización de las estadísticas para este estudio.
Adquisición de imágenes de RM
Para todos los pacientes incluidos en este estudio, se dispuso de secuencias ponderadas en T1 con contraste y se obtuvieron en el escáner Siemens Trio de 3,0T con los siguientes parámetros: TR/TE/TI = 1900/2,26/900 ms, Flip angle = 9 °, 20 cortes axiales con espesor = 5 mm, FOV axial = 25,6 × 25,6 cm2 y matriz de datos = 256 × 256. La imagen ponderada en T1 con contraste utilizó gadopentetato dimeglumina (0,1 mmol/Kg) como agente de contraste para la imagen con contraste, y los datos multidireccionales de la RM con contraste se recogieron durante el tiempo de intervalo continuo de 90-250 s.
Extracción de texturas
En nuestro estudio, se utilizó el paquete LifeX (http://www.lifexsoft.org) para extraer características de textura. Se seleccionaron las imágenes ponderadas en T1 (T1C) después del contraste para su posterior análisis debido a la clara representación de la ubicación y el borde del tumor (20). Se trazó manualmente una región de interés (ROI) en el plano axial a lo largo de las lesiones en las imágenes con contraste para obtener características de textura. Dos neurocirujanos experimentados, ciegos a las historias clínicas de los pacientes y al diagnóstico histopatológico, dibujaron la región de interés, seguida de la edición por parte de un radiólogo senior y un neurocirujano senior. Los desacuerdos se abordaron discutiendo y consultando con el radiólogo senior y el neurocirujano senior. Se extrajeron un total de 40 características de textura de las imágenes de RM, incluyendo minValue, meanValue, maxValue, stdValue y parámetros derivados de seis matrices: Matriz basada en el histograma (HISTO), Forma, Matriz de co-ocurrencia de nivel de grises (GLCM), Matriz de longitud de recorrido de nivel de grises (GLRLM), Matriz de longitud de zona de nivel de grises (GLZLM), y Matriz de dependencia de nivel de grises del vecindario (NGLDM).
Selección de características
Hubo 40 características de textura en total derivadas de seis matrices seleccionadas. La explicación de las 40 características de textura se muestra en la Tabla Suplementaria 1. Las estadísticas de estas características de textura se muestran en la Tabla Suplementaria 2. La selección de características se llevó a cabo para determinar las características relevantes y evitar así el sobreajuste. Además, el algoritmo de aprendizaje automático aplicado en este estudio no podía analizar las 40 características de textura. Se utilizaron tres métodos independientes de selección de características para seleccionar las características óptimas de textura, incluyendo la Correlación de Distancia, el operador de selección y contracción mínima absoluta (LASSO), y el árbol de decisión de correlación de gradiente (GBDT). Se formaron así tres subconjuntos de características de textura que constituyeron tres conjuntos de datos diferentes.
Clasificación
El análisis discriminante lineal (LDA) es un método de clasificación robusto para separar dos clases mediante la búsqueda de la combinación lineal de predictores que maximiza la separación entre grupos. En este estudio, se establecieron tres modelos de clasificación basados en el algoritmo LDA: Correlación de distancia + LDA, LASSO + LDA y GBDT + LDA. Los conjuntos de datos se introdujeron en el algoritmo LDA, respectivamente, y de forma independiente. Cada conjunto de datos se dividió aleatoriamente en un grupo de entrenamiento y otro de validación en una proporción de 4:1. El modelo entrenado por el grupo de entrenamiento se aplicó al grupo de validación independiente para evaluar su rendimiento. Para valorar la robustez del algoritmo LDA, se repitió el procedimiento durante 100 ciclos con una asignación de casos diferente, aleatoria e independiente. Se determinó una matriz de confusión utilizando la asignación verdadera de la histopatología y las predicciones del algoritmo LDA. Se calcularon la sensibilidad estándar, la especificidad, las áreas bajo la curva de características operativas del receptor (AUC) y la precisión, tanto para el grupo de entrenamiento como para el de validación, a fin de revelar la capacidad de discriminación de los modelos. Se llevó a cabo la comparación de tres modelos (Correlación de distancia + LDA, LASSO + LDA y GBDT + LDA) para determinar el modelo discriminativo óptimo para el glioblastoma y el ANA. El diagrama de flujo de la clasificación de IRM por características de textura se muestra en la Figura 1.
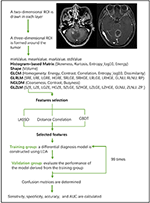
Figura 1. Diagrama de flujo de la clasificación de la RM por características de textura. ANA, astrocitoma anaplásico; LDA, análisis discriminante lineal; MRI, imagen de resonancia magnética; LASSO, operador de selección y contracción mínima absoluta; GBDT, árbol de decisión de correlación de gradiente; HISTO, matriz basada en histograma; GLCM, matriz de co-ocurrencia de nivel de grises; GLRLM, matriz de longitud de recorrido de nivel de grises; GLZLM, matriz de longitud de zona de nivel de grises; NGLDM, matriz de dependencia de nivel de grises del vecindario; AUC, área bajo la curva característica operativa del receptor.
Resultados
Características de los pacientes
Un total de 133 pacientes con glioblastoma (n = 76) o ANA (n = 57) cumplieron los criterios de inclusión. Todos los pacientes con glioblastoma se inscribieron en este estudio, mientras que 10 pacientes con ANA fueron excluidos de acuerdo con los criterios de exclusión. Finalmente, se incluyeron en este estudio 76 pacientes con glioblastoma y 46 pacientes con ANA. La edad media de los pacientes era de 46,9 (15-67) y 40,0 (7-69), respectivamente. Todos los pacientes se sometieron a la resección quirúrgica del tumor en nuestro departamento de neurocirugía de 2015 a 2018. La figura 2 muestra dos casos del plano axial de imágenes mejoradas con contraste en pacientes con glioblastoma y ANA.
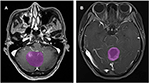
Figura 2. Ejemplos de dos casos de las imágenes de RM con contraste en pacientes con glioblastoma y ANA. (A) Imágenes con contraste con ANA, (B) imágenes con contraste con glioblastoma. ANA, astrocitoma anaplásico.
Glioblastoma vs. ANA
En este estudio se analizaron tres modelos, incluyendo Correlación de Distancia + LDA, LASSO + LDA, GBDT + LDA. Las características de textura utilizadas para la clasificación en estos modelos se mostraron en la Tabla Suplementaria 3. El rendimiento de cada modelo se presentó en la Tabla 1 (incluyendo sensibilidad, especificidad, precisión y AUC del grupo de entrenamiento y de validación). LASSO + LDA obtuvo el mejor rendimiento con los mayores AUC tanto en el grupo de entrenamiento como en el de validación. La sensibilidad, la especificidad, la precisión y el AUC para su grupo de entrenamiento fueron de 0,989, 0,993, 0,996 y 0,997, respectivamente; y para el grupo de validación, fueron de 0,927, 0,989, 0,968 y 0,974, respectivamente. Además, la correlación de distancia + LDA y GBDT + LDA también mostraron una capacidad prometedora para discriminar el glioblastoma del ANA, con un AUC ≥0,95 tanto para los grupos de entrenamiento como para los de validación.

Tabla 1. Discriminación entre glioblastoma y ANA.
La figura 3 muestra la relación entre las funciones canónicas de discriminación de los modelos LASSO + LDA para los grupos de glioblastoma y ANA (triángulos y círculos) y para los centroides de los grupos (cuadrados). En esta figura se observó un solapamiento mínimo. Cualitativamente, el análisis de los datos seleccionados por LASSO pudo separar el glioblastoma del ANA. La figura 4 muestra la distribución de la función LDA directa determinada para el glioblastoma y el ANA para uno de los 100 ciclos de entrenamiento independientes en el análisis de datos para ilustrar el rendimiento del modelo LASSO + LDA. Hubo claros desplazamientos de los valores de la función LDA, con un desplazamiento a la izquierda para el ANA y a la derecha para el glioblastoma.
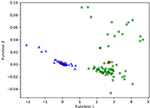
Figura 3. Relación entre las funciones canónicas discriminativas de los modelos LASSO + LDA para los grupos de glioblastoma y ANA (triángulos y círculos) y para los centroides de los grupos (cuadrados). En esta figura se observó un solapamiento mínimo. Cualitativamente, el análisis de los datos seleccionados por LASSO pudo separar el glioblastoma del ANA. LASSO, operador de selección y reducción mínima absoluta; LDA, análisis discriminante lineal; ANA, astrocitoma anaplásico.
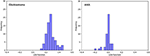
Figura 4. Distribución de la función LDA directa determinada para el glioblastoma y ANA para uno de los 100 ciclos de entrenamiento independientes en el análisis de datos para ilustrar el rendimiento del modelo LASSO + LDA. Hubo claros desplazamientos de los valores de la función LDA, con un desplazamiento a la izquierda para el ANA y a la derecha para el glioblastoma. Se observa un solapamiento mínimo entre los dos grupos y una fuerte similitud cualitativa entre los gráficos de ciclos y triángulos. LDA, análisis discriminante lineal; ANA, astrocitoma anaplásico; LASSO, operador de selección y reducción mínima absoluta.
Discusión
El diagnóstico diferencial previo al tratamiento entre el glioblastoma y el ANA es importante teniendo en cuenta la diferencia significativa en la estrategia de tratamiento y el pronóstico del paciente. La resonancia magnética, el principal examen radiológico preoperatorio para los tumores cerebrales, es muy recomendable por su buena sensibilidad en la detección de la lesión. Sin embargo, el diagnóstico preciso antes de la operación sigue siendo un reto debido a que ambos tumores presentan características similares en las imágenes de RM convencionales que están más allá de la evaluación humana a simple vista (4, 5). En este estudio, extrajimos características de textura haciendo una descripción cuantitativa de las imágenes para maximizar la utilización del examen de RM, con lo que se establecieron tres modelos basados en LDA. Los resultados demostraron que el análisis de textura basado en la RM combinada con el algoritmo LDA podría permitir la diferenciación factible entre el glioblastoma y el ANA.
TA es un enfoque matemático para caracterizar la heterogeneidad del valor del voxel en las imágenes. Podría visualizar la heterogeneidad histológica espacial que es invisible a la evaluación del ojo humano (21). Teóricamente, las características de las imágenes de las lesiones podrían analizarse cuantitativamente como características de textura debido a sus diferentes patrones de realce en las imágenes de RM (22). Además, estudios anteriores sugieren que las características de textura podrían reflejar una serie de procesos patológicos anormales del tumor, como edema, derrame y necrosis, proporcionando un mecanismo potencial para las características de textura en la discriminación del glioblastoma del ANA (23, 24).
La inteligencia artificial ha sido ampliamente explorada en investigaciones recientes. En combinación con las características de textura extraídas de las imágenes, se ha informado de que ayuda a la clasificación de los tumores, al diagnóstico clínico y a la predicción de los resultados. Un estudio destinado a evaluar el rendimiento diagnóstico de los algoritmos de aprendizaje automático basados en el AT para diferenciar el LPSNC del glioblastoma presentó un rendimiento óptimo con un AUC medio de 0,921, mientras que los AUC de tres lectores fueron todos <0,8. Así, los investigadores concluyeron que el rendimiento diagnóstico de los algoritmos de aprendizaje automático basados en la AT era superior al de los lectores humanos (25). Otros estudios con fines similares también demostraron resultados similares con AUC superiores a 0,85 (18, 26). Además, los investigadores que pretendían aplicar el aprendizaje automático en la clasificación de astrocitomas también informaron de una capacidad de discriminación prometedora (27). En nuestro estudio, los modelos de clasificación se establecieron basándose en los algoritmos LDA. El LDA es un clasificador estadístico que combina los parámetros introducidos en una función discriminante para clasificar los casos en diferentes grupos (28). Nuestros resultados demostraron que el modelo basado en LDA representaba un rendimiento prometedor en el diagnóstico preciso entre el glioblastoma y el ANA.
La adopción de características óptimas para los algoritmos de aprendizaje automático fue un reto, pero era necesario en relación con el rendimiento del diagnóstico. Los estudios anteriores realizan la selección de características con métodos variados: Prueba U de Mann-Whitney con AUC del ROC, prueba t de Student con eliminación recursiva de características, bosque aleatorio y discretización basada en la entropía, respectivamente (18, 25, 29, 30). Basándonos en los resultados de estos estudios, podríamos llegar a la conclusión de que el método de selección adecuado juega un papel clave en el rendimiento del clasificador. En cuanto a nuestro estudio, se extrajo un número relativamente grande de parámetros de diferentes matrices, lo que aumenta la posibilidad de seleccionar las características óptimas, pero también aumenta la dificultad de la selección. Por lo tanto, se evaluaron tres métodos de selección de características (Correlación de Distancia, LASSO y GBDT) para seleccionar el de mejor rendimiento. Los resultados de este estudio demostraron que LASSO+LDA era el modelo discriminativo adecuado para el glioblastoma a partir del ANA, con un AUC más alto en el grupo de prueba de 0,997. LASSO se propuso como un método de selección de variables no lineales para la red neuronal en un estudio anterior con la ventaja de minimizar la suma común de errores al cuadrado. Podía producir modelos interpretables (similares a la selección de subconjuntos) al tiempo que mostraba la estabilidad de la regresión de cresta. Un estudio anterior ilustró que representaba un rendimiento superior a otros métodos de selección de variables del estado de la técnica (31). Sin embargo, debemos interpretar los resultados con cautela, ya que la ganancia adicional de información al comparar diferentes técnicas de aprendizaje automático es bastante limitada, especialmente si se tiene en cuenta que todos los métodos de selección de clasificadores/características investigados parecen tener un rendimiento bastante comparable y la variación en el AUC puede atribuirse parcialmente al grupo estadístico. Por lo tanto, nuestro estudio sólo puede considerarse como una generación de hipótesis para futuros estudios más amplios.
Nuestro estudio tiene algunas limitaciones. En primer lugar, al ser un estudio retrospectivo de un solo centro, el sesgo en la selección de pacientes era inevitable. En segundo lugar, el número de pacientes incluidos era relativamente pequeño, y se requería un mayor número de pacientes en estudios posteriores para validar los resultados. En tercer lugar, el ANA se divide ahora en tres categorías según la clasificación de los tumores del sistema nervioso central de la Organización Mundial de la Salud de 2016: IDH-mutante, IDH-tipo salvaje y NOS (32). La capacidad del aprendizaje automático para discriminar los subtipos de ANA debe explorarse en futuros estudios. En cuarto lugar, los modelos de aprendizaje automático de nuestro estudio no se validaron realmente en otros conjuntos de datos. No adoptamos conjuntos de datos de otras instituciones porque las características de textura podrían ser diferentes cuando se extraen de imágenes adquiridas con diversos escáneres o protocolos. Esto podría considerarse un arma de doble filo. Por un lado, se podría proporcionar un conjunto de variables controladas; por otro, no se podría garantizar la aplicación generalizada de los resultados. El protocolo de análisis y el procedimiento de procesamiento de imágenes eran paquetes de código abierto y se requiere un estudio con una gran población para validar y reproducir nuestros resultados.
Conclusión
En este trabajo, extrajimos parámetros cuantitativos de imágenes de RM con contraste y utilizamos tres métodos de selección de características para seleccionar los parámetros más discriminantes. Luego aplicamos el algoritmo LDA para analizar los parámetros seleccionados. Nuestro estudio muestra que las características de textura tienen una capacidad prometedora para discriminar el glioblastoma del ANA. Se justifica la realización de estudios multicéntricos con un mayor número de pacientes para confirmar este resultado preliminar.
Disponibilidad de los datos
Estamos encantados de compartir nuestros datos con cualquier investigador cualificado sin reservas indebidas. Por favor, póngase en contacto con el autor correspondiente si hay algo que necesiten.
Declaración ética
Los estudios con participantes humanos fueron revisados y aprobados por el Comité de Ética de la Universidad de Sichuan. El consentimiento informado por escrito para participar en este estudio fue proporcionado por el tutor legal/próximo familiar de los participantes. Se obtuvo el consentimiento informado por escrito de la(s) persona(s), y del tutor legal/próximo familiar de los menores, para la publicación de cualquier imagen o dato potencialmente identificable incluido en este artículo.
Contribuciones de los autores
ZT, CC, JX y XM contribuyeron a la concepción y el diseño del estudio. CC y XO inscribieron a los pacientes elegibles y obtuvieron los registros médicos y las imágenes de resonancia magnética de cada paciente. YF y ZT realizaron el análisis de la textura. JW estableció los modelos y realizó otros análisis estadísticos. ZT escribió el primer borrador del manuscrito. CC escribió secciones del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Material suplementario
El material suplementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abreviaturas
ANA, astrocitoma anaplásico; LDA, análisis discriminante lineal; MRI, resonancia magnética; MR, resonancia magnética; LASSO, operador de selección y contracción mínima absoluta; GBDT, árbol de decisión de correlación de gradiente; LCR, líquido cefalorraquídeo; TA, análisis de textura; ROI, regiones de interés; HISTO: matriz basada en histogramas; GLCM: matriz de co-ocurrencia de nivel de grises; GLRLM: matriz de longitud de recorrido de nivel de grises; GLZLM: matriz de longitud de zona de nivel de grises; NGLDM: matriz de dependencia de nivel de grises del vecindario; AUC: área bajo la curva de características operativas del receptor; PCNSL: linfoma primario del sistema nervioso central; MLP: perceptrón multicapa; IDH: isocitrato deshidrogenasa.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Estadísticas del cáncer en China, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Gliomas malignos en adultos. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Anaplastic astrocytoma. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnóstico y tratamiento; revisión bibliográfica reciente. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. Guía de la EANO para el diagnóstico y tratamiento de los gliomas anaplásicos y el glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Anatomía topográfica y correlaciones de TC en el glioblastoma multiforme no tratado. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Quimioterapia con temozolomida sola versus radioterapia sola para el astrocitoma maligno en los ancianos: el ensayo aleatorio de fase 3 NOA-08. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Avances en la evaluación de los tumores cerebrales primarios. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme y astrocitoma anaplásico. Criterios patológicos e implicaciones pronósticas. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastoma y otros gliomas malignos: una revisión clínica. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Diferenciación del leiomiosarcoma uterino del leiomioma atípico: precisión diagnóstica de las características cualitativas de las imágenes de RM y viabilidad del análisis de textura. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Textural analysis of contrast-enhanced MR images of the breast. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Análisis de textura de imágenes médicas. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Evaluación de la heterogeneidad tumoral: ¿una herramienta de imagen emergente para la práctica clínica? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastoma y linfoma primario del sistema nervioso central: diferenciación preoperatoria mediante el uso de análisis de textura 3D basado en la RM. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Las características de las imágenes de resonancia magnética identifican subtipos fenotípicos de glioblastoma con actividades de vías moleculares distintas. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: un programa gratuito para el cálculo de características radiómicas en imágenes multimodales para acelerar los avances en la caracterización de la heterogeneidad del tumor. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. MRI multiparamétrica y análisis de textura para visualizar la heterogeneidad histológica espacial y la extensión del tumor en el glioblastoma. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Imágenes de resonancia magnética multiparamétrica en la evaluación de los tumores cerebrales primarios a través de las características radiómicas: una métrica para la planificación del tratamiento de radiación guiada. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. The impact of image dynamic range on texture classification of brain white matter. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Valor pronóstico de las características de textura de la tomografía computarizada en los cánceres de pulmón de células no pequeñas tratados con quimiorradioterapia definitiva concomitante. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Linfoma primario del sistema nervioso central y glioblastoma atípico: diferenciación mediante un enfoque radiómico. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Resonancia magnética multiparamétrica para diferenciar gliomas de alto grado y metástasis cerebrales. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. An image-analysis system based on support vector machines for automatic grade diagnosis of brain-tumour astrocytomas in clinical routine. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, y LDA: un análisis comparativo en datos EMG de personas con amputación trans-radial. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Clasificación de las formas progresivas de seguimiento del glioblastoma multiforme frente a las formas que responden utilizando características multiparamétricas de la RM. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Three-dimensional textural features of conventional MRI improve diagnostic classification of childhood brain tumours. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Design and application of a variable selection method for multilayer perceptron neural network with LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. La clasificación de tumores del sistema nervioso central de la Organización Mundial de la Salud de 2016: un resumen. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar




