Química
La formación de una disolución es un ejemplo de proceso espontáneo, un proceso que ocurre en condiciones específicas sin necesidad de energía de alguna fuente externa. A veces agitamos una mezcla para acelerar el proceso de disolución, pero esto no es necesario; se formaría una solución homogénea si esperamos el tiempo suficiente. El tema de la espontaneidad es de vital importancia para el estudio de la termodinámica química y se trata con más detalle en un capítulo posterior de este texto. Para los fines de la discusión de este capítulo, bastará con considerar dos criterios que favorecen, pero no garantizan, la formación espontánea de una solución:
- una disminución de la energía interna del sistema (un cambio exotérmico, como se discutió en el capítulo anterior sobre la termoquímica)
- un aumento del desorden en el sistema (que indica un aumento de la entropía del sistema, como aprenderá en el capítulo posterior sobre la termodinámica)
En el proceso de disolución, un cambio de energía interna a menudo, pero no siempre, se produce como el calor es absorbido o evolucionado. Siempre se produce un aumento del desorden cuando se forma una solución.
Cuando las fuerzas intermoleculares de atracción entre las especies del soluto y del disolvente en una solución no son diferentes de las presentes en los componentes separados, la solución se forma sin ningún cambio energético acompañante. Una solución de este tipo se denomina solución ideal. Una mezcla de gases ideales (o de gases como el helio y el argón, que se aproximan mucho al comportamiento ideal) es un ejemplo de solución ideal, ya que las entidades que componen estos gases no experimentan atracciones intermoleculares significativas.
Cuando se conectan recipientes de helio y argón, los gases se mezclan espontáneamente debido a la difusión y forman una solución (Figura 2). La formación de esta solución implica claramente un aumento del desorden, ya que los átomos de helio y argón ocupan un volumen dos veces mayor que el que ocupaba cada uno antes de la mezcla.
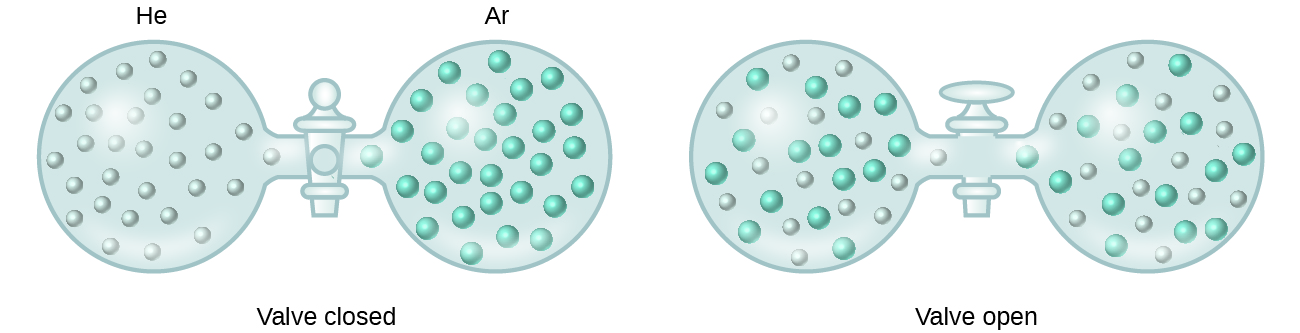
También pueden formarse soluciones ideales cuando se mezclan líquidos estructuralmente similares. Por ejemplo, las mezclas de los alcoholes metanol (CH3OH) y etanol (C2H5OH) forman soluciones ideales, al igual que las mezclas de los hidrocarburos pentano, C5H12, y hexano, C6H14. Si se colocan metanol y etanol, o pentano y hexano, en los focos mostrados en la figura 2, se producirá la misma difusión y posterior mezcla de estos líquidos que la observada para los gases He y Ar (aunque a un ritmo mucho más lento), dando lugar a soluciones sin cambios significativos en la energía. Sin embargo, a diferencia de una mezcla de gases, los componentes de estas soluciones líquido-líquido sí experimentan fuerzas de atracción intermoleculares. Pero como las moléculas de las dos sustancias que se mezclan son estructuralmente muy similares, las fuerzas de atracción intermoleculares entre las moléculas similares y las diferentes son esencialmente las mismas, y el proceso de disolución, por lo tanto, no implica ningún aumento o disminución apreciable de la energía. Estos ejemplos ilustran cómo la difusión por sí sola puede proporcionar la fuerza motriz necesaria para provocar la formación espontánea de una solución. En algunos casos, sin embargo, las magnitudes relativas de las fuerzas intermoleculares de atracción entre las especies de soluto y disolvente pueden impedir la disolución.
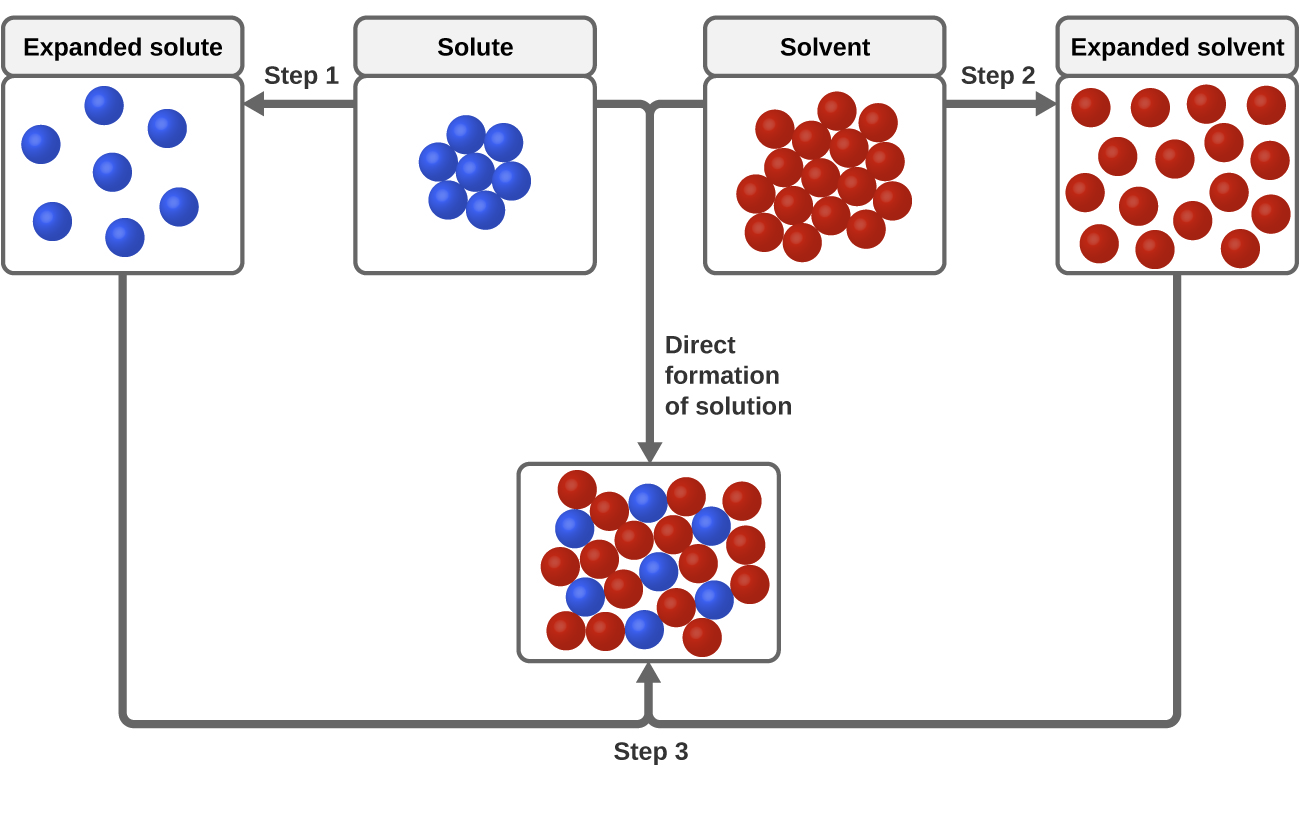
Tres tipos de fuerzas intermoleculares de atracción son relevantes para el proceso de disolución: soluto-soluto, disolvente-disolvente y disolvente-solución. Como se ilustra en la Figura 3, la formación de una solución puede considerarse un proceso gradual en el que se consume energía para superar las atracciones soluto-soluto y disolvente-disolvente (procesos endotérmicos) y se libera cuando se establecen las atracciones soluto-disolvente (un proceso exotérmico denominado solvatación). Las magnitudes relativas de los cambios de energía asociados a estos procesos escalonados determinan si el proceso de disolución en general liberará o absorberá energía. En algunos casos, no se forman soluciones porque la energía necesaria para separar las especies de soluto y disolvente es mucho mayor que la energía liberada por la solvatación.
Por ejemplo, los aceites de cocina y el agua no se mezclan en una medida apreciable para producir soluciones (Figura 4). El enlace de hidrógeno es la fuerza de atracción intermolecular dominante presente en el agua líquida; las moléculas de hidrocarburos no polares de los aceites de cocina no son capaces de crear enlaces de hidrógeno, sino que se mantienen unidas por fuerzas de dispersión. Para formar una solución de aceite y agua sería necesario superar el fuerte enlace de hidrógeno del agua, así como las fuerzas de dispersión significativamente fuertes entre las moléculas de aceite relativamente grandes. Y, puesto que las moléculas polares de agua y las moléculas no polares de aceite no experimentarían una atracción intermolecular muy fuerte, se liberaría muy poca energía por solvatación.

Por otro lado, una mezcla de etanol y agua se mezclará en cualquier proporción para producir una solución. En este caso, ambas sustancias son capaces de establecer enlaces de hidrógeno, por lo que el proceso de solvatación es lo suficientemente exotérmico como para compensar las separaciones endotérmicas de las moléculas de soluto y disolvente.
Como se señaló al principio de este módulo, la formación espontánea de soluciones se ve favorecida, pero no garantizada, por los procesos de disolución exotérmica. Mientras que muchos compuestos solubles se disuelven, de hecho, con la liberación de calor, algunos se disuelven endotérmicamente. El nitrato de amonio (NH4NO3) es uno de estos ejemplos y se utiliza para fabricar compresas frías instantáneas para tratar lesiones como la que se muestra en la Figura 5. Una bolsa de plástico de paredes finas con agua está sellada dentro de una bolsa más grande con NH4NO3 sólido. Cuando se rompe la bolsa más pequeña, se forma una solución de NH4NO3 que absorbe el calor del entorno (la zona lesionada a la que se aplica la compresa) y proporciona una compresa fría que disminuye la hinchazón. Las disoluciones endotérmicas como ésta requieren un mayor aporte de energía para separar las especies de solutos que el que se recupera cuando los solutos se disuelven, pero no obstante son espontáneas debido al aumento del desorden que acompaña a la formación de la solución.


Vea este breve vídeo que ilustra los procesos de disolución endotérmicos y exotérmicos.
Conceptos clave y resumen
Una solución se forma cuando dos o más sustancias se combinan físicamente para dar lugar a una mezcla que es homogénea a nivel molecular. El disolvente es el componente más concentrado y determina el estado físico de la solución. Los solutos son los demás componentes que suelen estar presentes en concentraciones inferiores a las del disolvente. Las soluciones pueden formarse de forma endotérmica o exotérmica, dependiendo de las magnitudes relativas de las fuerzas de atracción intermolecular del soluto y del disolvente. Las soluciones ideales se forman sin un cambio apreciable de energía.
Ejercicios de fin de capítulo de Química
- ¿En qué se diferencian las soluciones de los compuestos? De otras mezclas?
- ¿Cuáles de las principales características de las disoluciones podemos observar en las disoluciones de K2Cr2O7 que se muestran en la figura 1?
- Cuando el KNO3 se disuelve en agua, la disolución resultante es significativamente más fría de lo que era el agua originalmente.
(a) ¿Es la disolución del KNO3 un proceso endotérmico o exotérmico?
(b) ¿Qué conclusiones puedes sacar sobre las atracciones intermoleculares implicadas en el proceso?
(c) ¿Es la solución resultante una solución ideal?
- Da un ejemplo de cada uno de los siguientes tipos de soluciones:
(a) un gas en un líquido
(b) un gas en un gas
(c) un sólido en un sólido
- Indica los tipos de atracciones intermoleculares más importantes en cada una de las siguientes soluciones:
(a) La solución de la figura 1.
(b) NO(l) en CO(l)
(c) Cl2(g) en Br2(l)
(d) HCl(aq) en benceno C6H6(l)
(e) Metanol CH3OH(l) en H2O(l)
.
- Predice si cada una de las siguientes sustancias sería más soluble en agua (disolvente polar) o en un hidrocarburo como el heptano (C7H16, disolvente no polar):
(a) aceite vegetal (no polar)
(b) alcohol isopropílico (polar)
(c) bromuro de potasio (iónico)
- El calor se libera cuando se forman algunas soluciones; el calor se absorbe cuando se forman otras soluciones. Proporcione una explicación molecular para la diferencia entre estos dos tipos de procesos espontáneos.
- Soluciones de hidrógeno en paladio pueden formarse exponiendo el metal Pd al gas H2. La concentración de hidrógeno en el paladio depende de la presión de gas H2 aplicada, pero de una forma más compleja que la que puede describir la ley de Henry. Bajo ciertas condiciones, se disuelven 0,94 g de gas hidrógeno en 215 g de paladio metálico.
(a) Determine la molaridad de esta solución (densidad de la solución = 1,8 g/cm3).
(b) Determine la molalidad de esta solución (densidad de la solución = 1,8 g/cm3).
(c) Determine el porcentaje en masa de átomos de hidrógeno en esta solución (densidad de la solución = 1,8 g/cm3).




