CHEM 245 – Entsyymin inhibitio
Biokemian aihepiirit
Entsyymin inhibitio
Inhibiittorien tyypit ja inhibitio.Käänteiset ja palautumattomat inhibiittorit ja inhibitio. Kilpailevan ja ei-kilpailevan inhibition mallit ja kineettiset vaikutukset. Sekamuotoinen inhibitio.Esimerkkejä entsyymi-inhibitiosta.
Ensiymien spesifisyys ei rajoitu tiukasti substraatteihin. Usein entsyymin aktiivisuutta vähentävät spesifiset vuorovaikutukset inhibiittoreiksi kutsuttujen molekyylien kanssa. Entsyymi-inhibitio on yksi biokemian tärkeimmistä ilmiöistä. Esimerkiksi monet lääkkeet, antibiootit ja toksiinit vaikuttavat siten, että ne kykenevät estämään entsyymiä. Rakenteeltaan substraattia muistuttavat inhibiittorit ovat usein kilpailevia inhibiittoreita, koska ne kilpailevat sitoutumisesta aktiiviseen kohtaan. Entsyymin inhibitio voi olla reversiibeliä (kuten yleensä silloin, kun inhibiittori sitoutuu entsyymiin ei-kovalenttisten vuorovaikutusten kautta) tai irreversiibeliä (kuten tapahtuu lukuisissa tapauksissa, joissa inhibiittorit vaikuttavat entsyymiin kohdistuvien kovalenttisten modifikaatioiden kautta, jotka ehkä kohdistuvat katalyysin kannalta kriittiseen jäännökseen).
Voimme kuvitella useita yksinkertaisia malleja reversiibeliä inhibitiota varten. Yksinkertaisin näistä on inhibiittorin suora sulkeutuminen aktiiviseen kohtaan. Tämä nähtäisiin silloin, kun kyseessä on molekyyli, jolla on jonkin verran rakenteellista samankaltaisuutta substraatin kanssa. Tässä kilpailullisen eston mallissa substraatin ja inhibiittorin sitoutuminen sulkevat toisensa pois.
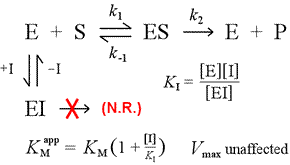
Oikealla on esitetty yksinkertainen mekanistinen malli kilpailevalle inhibitiolle. Inhibiittori I sitoutuu vain vapaaseen entsyymiin E, jonka dissosiaatiovakio KI , ja estää substraatin (S) sitoutumisen. Sitomalla osan entsyymistä inaktiiviseen EI-kompleksiin, sitä on tietyllä substraattikonsentraatiolla vähemmän käytettävissä yhdistyäkseen substraatin kanssa ja muodostaakseen ES:n ja muuntuakseen sitten mahdollisesti tuotteiksi. Havaitaan, että ½Vmax:n saavuttamiseen tarvittava aika kasvaa, joten KM:n näennäinen arvo kasvaa.
Nousemalla yhä suurempiin pitoisuuksiin substraatti voi hukuttaa inhibiittorin, jolloin se kilpailee vapaan entsyymin kanssa siinä määrin, että todellista Vmax-arvoa voidaan vielä lähestyä.
Voidaan helposti kuvitella, että molekyyli, joka muistuttaa substraattia tietyiltä keskeisiltä rakenteellisilta ominaisuuksiltaan, voisi kilpailla substraatin kanssa sitoutumisesta aktiiviseen kohtaan. Tätä kutsutaan substraattianalogiksi, ja ne ovat yleisiä esimerkkejä entsyymien kilpailevista inhibiittoreista. Jos entsyymit tehostavat reaktionopeutta vakauttamalla selektiivisesti reaktion siirtymätilaa, jos löydämme molekyylin, joka muistuttaa siirtymätilaa (rakenteeltaan ja napaisuudeltaan tai varaukseltaan), tällaisen siirtymätilan analogin pitäisi olla erittäin hyvä kilpailullinen inhibiittori.
Kontrastoimme kilpailullisen inhibitiomallin ei-kilpailulliseen inhibitioon, jossa inhibiittori sitoutuu vain entsyymi-substraatti-kompleksiin. Voidaan kuvitella tämän tapahtuvan indusoidun sovituksen tyyppisen entsyymi-substraatti-vuorovaikutuksen seurauksena, jossa inhibiittorin sitoutumiskohta on käytettävissä yksinomaan ES:n indusoidussa konformaatiossa.
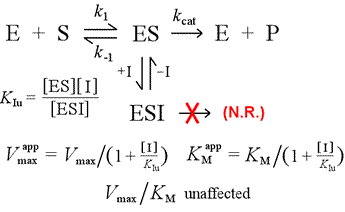
Vasemmalla: Mekanistinen malli ei-kompetitiiviselle inhibitiolle. Tässä mallissa inhibiittori sitoutuu vain ES-kompleksiin eikä vapaaseen entsyymiin. Ternäärinen kompleksi, ESI, ei etene tuotteiksi. Tämä alentaa näennäistä Vmax-arvoa. ESI:n inhibiittorin dissosiaatiovakio on KIu. Le Châtelierin periaatteella selitettävän vaikutuksen mukaan näennäinen KM on alhaisempi, koska inhibiittorin sitoutuminen poistaa osan ES:n muodostumisen ”tasapainon” tuotteesta (ES).
Inhibitiomalli, jossa inhibiittori sitoo sekä vapaata entsyymiä että entsyymi-substraatti-kompleksia, on sekainhibitio. Inhibiittorin dissosiaatiovakio voi vaihdella E:n ja ES:n välillä (eli KI ≠ KIu). Erikoistapausta, jossa KI = KIu, kutsutaan nimellä ei-kilpaileva inhibitio. Huomaa, että tässä tapauksessa KM ei vaikuta, mutta Vmax laskee.
Reversiibelien entsyymi-inhibitioiden tyypit – yhteenveto
Olemme nähneet, että reversiibelien inhibitioiden eri mallit voidaan erottaa toisistaan kineettisiin parametreihin kohdistuvien vaikutusten perusteella. Seuraavassa taulukossa on yhteenveto inhibitiotyypeistä ja niiden vaikutuksista näihin parametreihin.

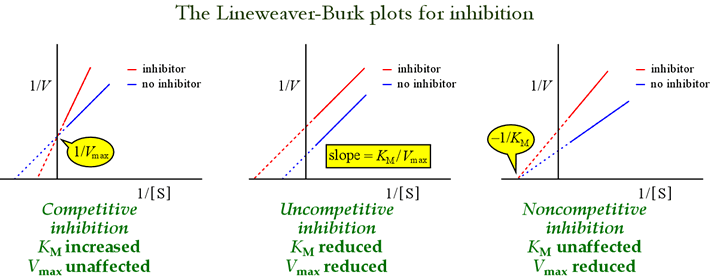
Lineweaver-Burk- eli kaksoisreciprocal-diagrammit ovat hyödyllisiä inhibitiomallien tunnistamisessa. Alla olevasta kuvasta käy ilmi, miten erityyppiset inhibitiot vaikuttavat kuvaajaan.
Esimerkkejä entsyymi-inhibitiosta
Ensimmäinen ja laajimmin käytetty lääke, asetyylisalisylaatti (salisylaatti = ortohydroksibentsoaatti), joka tunnetaan yleisesti nimellä aspiriini, on tehokas analgeetti (kivunlievittäjä), antipyreetti (kuumeen alentaja) ja tulehduskipulääke. Pajunkuoren lääkinnälliset ominaisuudet on tunnettu joissakin kulttuureissa vuosisatojen ajan. Aktiivinen ainesosa todettiin 1800-luvulla olevan yhdistelmä ja salisyylialkoholia. Näiden ja muiden havaintojen sekä kemiallisessa synteesissä tapahtuneiden edistysaskeleiden perusteella aspiriini tuli saataville vuosisadan puolivälissä, ja sen valmisti Bayerin palveluksessa ollut kemisti Hoffman. Nykyaikaisemmissa tutkimuksissa on todettu, että aspiriinin lääkinnälliset ominaisuudet johtuvat suurelta osin sen kyvystä estää palautumattomasti entsyymiä, joka tunnetaan nimellä syklo-oksygenaasi ja jota tarvitaan prostaglandiinien ja tromboksaanien synteesiin.
Syklo-oksygenaasit katalysoivat ensimmäisen askeleen arakidonaatin muuntamisessa prostaglandiinien ja tromboksaanien esiasteeksi, prostaglandiini G2:ksi (PGG2, rakenteet ja reaktio). Reaktiossa käytetään kaksi molekyyliä O2:ta ja muunnetaan C20:4 -rasvahappo peroksidoiduksi molekyyliksi, joka sisältää syklopentaanirenkaan (PGG2 – PG on lyhenne sanoista ”prostaglandiini”). Syklooksygenaasientsyymillä on myös hydroperoksidaasiaktiivisuus, joka muuntaa PGG2:n PGH2:ksi. Siten ”syklo-oksygenaasi” (COX) olisi tarkempi nimitys prostaglandiiniendoperoksidi-H-syntaasi (PGHS). Aspiriinin aiheuttama syklo-oksygenaasiaktiivisuuden esto johtuu sen kyvystä muuttaa kemiallisesti entsyymin seriinijäämää (Ser530). Seriinijäännös saa asetyyliryhmän aspiriinista, mikä on peruuttamaton muutos. Näin ollen aspiriini on esimerkki palautumattomasta inhibiittorista. COX-isoentsyymejä on itse asiassa kaksi: konstitutiivinen muoto, COX-1 (PGHS-1), ja indusoitunut muoto (tulehdusolosuhteissa), COX-2 (PGHS-2). Ei-steroidiset tulehduskipulääkkeet (NSAID-lääkkeet), kuten aspiriini, ibuprofeeni ja naprokseeni, estävät yleensä molempia isoformeja. Näin ollen nämä lääkkeet aiheuttavat ei-toivottuja sivuvaikutuksia, kuten ruoansulatuskanavan ärsytystä. Tämän vuoksi farmakologisen tutkimuksen nykyisenä tavoitteena on kehittää COX-2:lle spesifisiä estäjiä, joiden uskotaan välittävän suurimman osan NSAID-lääkkeiden analgeettisista ja anti-inflammatorisista vaikutuksista.
Sivut aiheeseen liittyvistä aiheista:
- johdanto kemialliseen kinetiikkaan
- johdanto entsymologiaan
- entsyymien kinetiikka
- Michaelis-Mentenin yhtälö




