entsyymin estäminen
Ensiymit ovat välttämättömiä useimmissa, ellei jopa kaikissa, elämässä tarvittavissa prosesseissa. Entsyymit katalysoivat reaktiota vähentämällä reaktion tapahtumiseen tarvittavaa aktivaatioenergiaa. Entsyymejä on kuitenkin säädeltävä tiukasti, jotta varmistetaan, että tuotteen määrä ei nouse ei-toivotulle tasolle. Tämä saavutetaan entsyymin inhibitiolla.
Inhibiittorin tyypit
Muuttuvat ja palautumattomat inhibiittorit ovat kemikaaleja, jotka sitoutuvat entsyymiin tukahduttaakseen sen aktiivisuuden. Yksi menetelmä tämän saavuttamiseksi on lähes pysyvä sitoutuminen entsyymiin. Tämäntyyppisiä inhibiittoreita kutsutaan peruuttamattomiksi. Muut kemikaalit voivat kuitenkin sitoutua entsyymiin ohimenevästi. Näitä kutsutaan palautuviksi. Reversiibelit inhibiittorit sitoutuvat joko aktiiviseen kohtaan (kilpailevat inhibiittorit) tai toiseen kohtaan entsyymissä (ei-kilpailevat inhibiittorit).
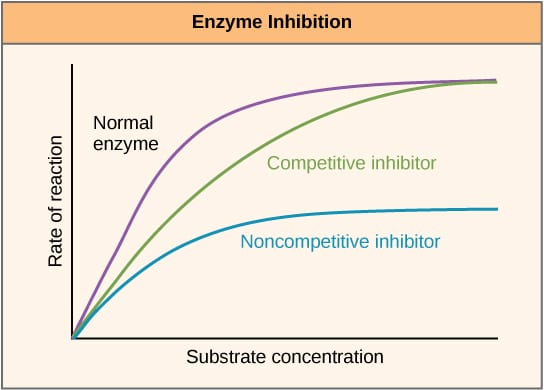
 Kuva 1 – Kaavio, josta käy ilmi kilpailevien ja ei-kilpailevien entsyymi-inhibiittoreiden vaikutus.
Kuva 1 – Kaavio, josta käy ilmi kilpailevien ja ei-kilpailevien entsyymi-inhibiittoreiden vaikutus.Kilpailevat inhibiittorit
Kilpailevat inhibiittorit kilpailevat substraatin kanssa aktiivisessa paikassa ja lisäävät siten Km:ää (Michaelis-Mentenin vakio). Vmax pysyy kuitenkin muuttumattomana, koska riittävällä substraattikonsentraatiolla reaktio voi silti päättyä. Entsyymiaktiivisuuden ja substraattikonsentraation välinen kuvaaja siirtyy oikealle Km:n nousun vuoksi, kun taas Lineweaver-Burke-kuvaaja on jyrkempi verrattuna siihen, että inhibiittoria ei olisi käytetty.
Ei-kilpailevat inhibiittorit
Ei-kilpailevat inhibiittorit sitoutuvat toiseen paikkaan entsyymissä ja pienentävät siten VMAX:ää. KM pysyy kuitenkin muuttumattomana. Tämän osoittaa pienempi maksimi kuvaajassa, jossa entsyymiaktiivisuus on piirretty substraattikonsentraation suhteen, ja korkeampi y-väliviiva Lineweaver-Burke-kuvaajassa verrattuna siihen, ettei inhibiittoria ole.
| Kompetitiivinen | Ei-kompetitiivinen | |
| Missä se vaikuttaa? | Aktiivinen toimipaikka | Vaihtoehtoinen toimipaikka |
| Km-muutos | Kasvu | Muuttumaton |
| Muutos Vmax | Muuttumaton | Vähennys |
 Kuva 2 – Vmaxin muutos
Kuva 2 – Vmaxin muutos
 . Kaavio, joka osoittaa entsyymi-inhibiittorien vaikutuksen reaktionopeuteen ja miten se vaihtelee substraatin pitoisuuden mukaan.
. Kaavio, joka osoittaa entsyymi-inhibiittorien vaikutuksen reaktionopeuteen ja miten se vaihtelee substraatin pitoisuuden mukaan.Allosterinen inhibitio
Allosterisilla entsyymeillä on sigmoidinen käyrä, toisin kuin Michaelis-Menten-entsyymien hyperbolinen käyrä. Tämä johtuu siitä, että useimmat allosteriset entsyymit sisältävät useita alayksiköitä, jotka voivat vaikuttaa toisiinsa, kun substraatti sitoutuu entsyymiin. Inhibitio voi vaikuttaa joko K0.5:een, joka on substraattikonsentraatio puolittaiseen kyllästymiseen, Vmax:iin tai molempiin. Tämä johtaa käyrän siirtymiseen oikealle, ja jos Vmax pienenee, käyrä siirtyy alaspäin.
Allosterisilla entsyymeillä on kaksi tilaa: matalan affiniteetin tila, jota kutsutaan ”T”-tilaksi, ja korkean affiniteetin ”R”- tila. Inhibiittorit toimivat sitoutumalla ensisijaisesti allosterisen entsyymin T-tilaan, mikä saa entsyymin pitämään yllä tätä matalan affiniteetin tilaa.
Tämä on erittäin hyödyllistä entsyymin tuotteen määrän rajoittamiseksi, koska tuote voi sen jälkeen siirtyä inhiboimaan samantyyppistä entsyymiä sen varmistamiseksi, että tuotteen määrä ei ole liiallinen. Tätä kutsutaan takaisinkytkentäinhibitioksi. Esimerkiksi ATP estää allosterisesti pyruvaattikinaasia estääkseen pyruvaatin lisääntyneen muodostumisen, jolloin ATP:tä muodostuu lopulta vähemmän. Lisäksi fosfofruktokinaasia estää allosterisesti sitraatti, joka on Krebin syklin välituote. Tämä tarkoittaa, että glykolyysiä rajoitetaan, kun Krebin syklin ATP:n muodostuminen on runsasta.
 Kuva 3 – Kaavio, josta käy ilmi sekä allosterisen inhiboinnin että aktivaation mekanismi.
Kuva 3 – Kaavio, josta käy ilmi sekä allosterisen inhiboinnin että aktivaation mekanismi.Fosforylaatio
Fosforylaatio tarjoaa toisen mekanismin, jolla entsyymejä voidaan inhiboida. Tämä tapahtuu tyypillisesti kinaasientsyymien vaikutuksesta, jotka voivat joko inhiboida tai aktivoida entsyymiä tilanteesta riippuen. Kinaasientsyymit pilkkovat ATP:stä fosfaattiryhmän ja sitovat sen entsyymiin. Tilanteissa, joissa tämä johtaa entsyymiaktiivisuuden lisääntymiseen, syntyy kaskadireaktio, jolloin pienestä ärsykkeestä saadaan aikaan suuri vaste.
Zymogeenit
Ensiymit voivat erittyä myös inaktiivisessa tilassa, joita kutsutaan zymogeeneiksi. Zymogeenit ovat hyödyllinen mekanismi, jonka avulla entsyymit voidaan kuljettaa turvallisesti eri paikkoihin ilman, että entsyymi muuttuu matkan varrella aktiiviseksi ja suorittaa tehtävänsä. Ne pysyvät inaktiivisina proteiiniin lisättyjen aminohappojen ansiosta. Siksi zymogeenin aktivoimiseksi toisen entsyymin on pilkottava nämä ylimääräiset aminohapot pois. Esimerkiksi kymotrypsinogeeni syntetisoidaan haimassa, mutta se on inaktivoitunut eikä voi toimia. Suolistoon kulkeutuessaan toinen entsyymi (trypsiini) pilkkoo ylimääräiset aminohapot pois tuottaakseen aktivoituneen muodon, kymotrypsiinin.
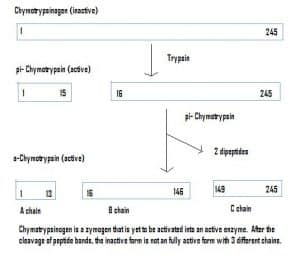 Kuva 4 – Kaavio, joka osoittaa kymotrypsiinogeenin aktivoitumisen ruoansulatuskanavassa ja kussakin vaiheessa mukana olevat entsyymit.
Kuva 4 – Kaavio, joka osoittaa kymotrypsiinogeenin aktivoitumisen ruoansulatuskanavassa ja kussakin vaiheessa mukana olevat entsyymit.Kliininen merkitys – Farmakokinetiikka
Tärkein kliininen entsyymin eston käyttö on lääkeaineiden käyttö. ACE:n estäjät ovat yleinen verenpainetaudin hoito. Angiotensiini I muuttuu angiotensiini II:ksi angiotensiinikonvertaasientsyymin (ACE) vaikutuksesta. Angiotensiini II aiheuttaa kuitenkin lukuisia vaikutuksia, jotka liittyvät verenpaineen nousuun. Siksi ACE:n estäjät on suunniteltu estämään kilpailevasti ACE:n toimintaa, jolloin Angiotensiini II:n muodostuminen vähenee ja verenpaine laskee.
Vaihtoehtoisesti penisilliini sitoutuu palautumattomasti DD-transpeptidaasiksi kutsutun entsyymin aktiiviseen kohtaan. DD-transpeptidaasi vastaa bakteerien soluseinän synteesin viimeisestä vaiheesta. Estämällä tätä entsyymiä bakteerit eivät voi syntetisoida soluseinää eivätkä näin ollen voi ylläpitää elämää.
Viimeiseksi syanidi on esimerkki ei-kilpailevasta inhibiittorista. Syanidi sitoutuu elektroninkuljetusketjun viimeiseen entsyymiin ja estää tätä entsyymiä katalysoimasta reaktiota hapesta vedeksi. Tämä estää elektronien kulun elektroninkuljetusketjussa, eikä ATP:tä voi syntyä, mikä johtaa kuolemaan.
Hyväksytty.




