Frontiers in Neuroscience
Introduction
Uusien hermosolujen muodostuminen aikuisten hippokampuksessa, aivojen alueella, joka on mukana avaruudellisessa navigoinnissa ja muistinmuodostuksessa (Buzsaki ja Moser, 2013), on silmiinpistävä plastisuuden muoto, joka säilyy koko elämän ajan useilla lajeilla, mukaan lukien ihmisillä (Altman ja Das, 1965; Eriksson et al.,, 1998; Moreno-Jiménez ym., 2019). Aikuisten hippokampuksen neurogeneesiä säätelevien monien olosuhteiden joukossa yksi luotettavimmista prosesseista, joita on kuvattu laajalti, on iän aiheuttama hermosolujen tuotannon väheneminen, kun taas jo olemassa olevat hermosolupopulaatiot pysyvät vakiona normaalin ikääntymisen myötä (Kuhn et ai., 1996; Kempermann et ai., 1998; Burke ja Barnes, 2010). Ikääntyminen vaikuttaa moniin toimintoihin aivoissa, kuten synaptiseen siirtoon ja plastisuuteen, joiden ajatellaan vaikuttavan muistin menetykseen (Burke ja Barnes, 2006; Fan et al., 2017). Koska hippokampus on erityisen altis ikään liittyville muutoksille ja neurodegeneraatiolle, strategioiden löytäminen plastisuuden lisäämiseksi tässä rakenteessa tulee merkitykselliseksi, jotta voidaan ehkäistä tai lievittää vanhenemisen vaikutuksia (Bartsch ja Wulff, 2015). Liikunta ja kognitiiviset ärsykkeet parantavat aivojen terveyttä ja pyrkivät lievittämään ikääntymisen vaikutuksia. Yksi suorista hyödyistä voi johtua aktiivisuudesta riippuvaisesta aivoista peräisin olevan neurotrofisen tekijän (BDNF) tason noususta, jonka on osoitettu palauttavan synaptisen plastisuuden, tehostavan neurogeneesiä ja parantavan oppimista keski-ikäisillä hiirillä (Marlatt ym., 2012; Trinchero ym., 2017). Liikunta vähentää myös mikroglian aktivaatiota, lisää aktiivisuudesta riippuvaa synaptista plastisuutta, hermoston esiasteen solujen lisääntymistä ja nopeuttaa aikuissyntyisten granulosolujen (GC) kehitystä ja integroitumista ikääntyvässä hippokampuksessa (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Nämä vaikutukset myötävaikuttavat hippokampuksesta riippuvan plastisuuden palauttamiseen ja korreloivat mukautuvan käyttäytymisen kanssa. Siten ikääntyneet eläimet, jotka suoriutuvat huonosti avaruudellisista oppimis- ja kuvionerotustehtävistä, parantavat suorituskykyään liikunnan jälkeen (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
Mittakaavassa, jossa neurogeneesi myötävaikuttaa liikunnan myönteisiin käyttäytymisvaikutuksiin ikääntyvillä eläimillä, on edelleen tutkinnan alla. On mahdollista, että fyysisen harjoittelun aiheuttama neurogeneesin nopeuden lisääntyminen vaikuttaa osaltaan käyttäytymisen paranemiseen. Mutta myös muut mekanismit voivat olla osallisina (Meshi ym., 2006). Uusien hermosolujen nopeutunut integroituminen ikääntyvässä dentate gyrusissa liikunnan jälkeen, mikä muuttaa uusien GC:iden laatua, voi myös vaikuttaa käyttäytymisen paranemiseen. Vaikka keski-ikäisillä hiirillä syntyneet neuronit kehittyvät hitaasti, jatkuva vapaaehtoinen liikunta edistää dendriittistä kasvua, selkärangan muodostumista ja neuronien integroitumista (Trinchero et ai., 2017). Samanlaisia vaikutuksia havaittiin lyhyillä altistuksilla ympäristön rikastamiselle (EE) (Trinchero et ai., 2019). Jos ne kumuloituvat useisiin neuronaalisiin kohortteihin, liikunnan käynnistämä nopeutettu neuronaalinen integraatio saattaa vaikuttaa merkittävästi hippokampuksesta riippuvaiseen oppimiseen ja käyttäytymiseen. Tässä työssä osoitamme, että useat uusien GC: n kohortit voidaan integroida nopeasti sellaisten hiirten ennestään olemassa oleviin piireihin, jotka jatkavat vapaaehtoista juoksemista, ja että nämä vaikutukset jatkuvat, kun hiiret ovat lopettaneet juoksemisen.
Materiaalit ja menetelmät
Hiiret ja kirurgia
C57BL / 6J-uroshiiret majoitettiin 4-5-eläimillä häkkiä kohti vakio-olosuhteissa. Kahdeksan kuukauden ikäiset (8M) hiiret valittiin, koska tämän iän jälkeen hippokampuksen neurogeneesi vähenee voimakkaasti, mikä estää leimattujen neuronien tutkimisen (Morgenstern et ai., 2008; Trinchero et ai., 2017). Hiiret nukutettiin (150 μg ketamiinia / 15 μg ksylatsiinia 10 μl suolaliuoksessa / g), ja retrovirus infusoitiin oikean dentate gyrusin septaaliselle alueelle (1,5 μl nopeudella 0,15 μl / min) käyttäen steriilejä kalibroituja mikrokapillaaripipettejä stereotaksisen leikkauksen avulla; koordinaatit bregmasta (mm): -2 anteroposterior, -1.5 lateraalisesti ja -1.9 ventriaalisesti. Ilmoitettuina aikoina aivot kiinnitettiin ja leikkaukset valmisteltiin konfokaalista kuvantamista varten (Trinchero et ai., 2017). Analyysiin otettiin mukaan vain septaalisen dentate gyrusin GC:t, jotka vastasivat hiiren aivojen atlaksen (Paxinos ja Franklin, 2001) mukaan -0,96-2,30 mm:n etäisyydelle bregmasta paikannettuja leikkauksia. Fundación Instituto Leloirin laitoseläinten hoito- ja käyttökomitea hyväksyi koeprotokollat Council for International Organizations for Medical Sciencesin eläimiä koskevan biolääketieteellisen tutkimuksen periaatteiden ja laboratorioeläinten hoidon ja käytön oppaassa (Guide for the Care and Use of Laboratory Animals) esitettyjen määräysten mukaisesti.
Juoksu
Juoksumatkat kirjattiin jokaista koetta varten langattomilla juoksupyörillä. Kuvan 1 kokeissa eläimiä pidettiin juoksupyörän kanssa 7 tai 21 päivän ajan, kuten ilmoitettu. Tässä tilassa hiiret juoksivat ∼2 km/vrk. Kuvioissa 2, 3, joissa hiiret juoksivat 1, 2 tai 3 kuukautta, seurattu matka oli ∼10 km/vrk.
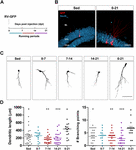
Kuva 1. Pitkät mutta eivät lyhyet juoksujaksot kiihdyttävät uusien GC:iden morfologista kypsymistä. (A) Koejärjestely. RV-GFP-injektiota seurasi altistuminen 1 viikon vapaaehtoiselle juoksemiselle ilmoitetuissa ikkunoissa tai koko kokeen ajan (0-21 dpi). (B) Edustavat kuvat 21 dpi:n GC:istä, jotka ilmentävät GFP:tä (punainen) ja jotka on otettu istumatyön ja 0-21 juoksun ryhmistä. NeuN (sininen) merkitsee granulussolukerrosta (GCL) (ML, molekyylikerros). Mittakaavapalkki, 50 μm. (C) Edustavat konfokaalikuvat 21 dpi:n GFP-GC:istä eri ryhmistä. Mittakaavapalkki, 50 μm. (D) Dendriittinen monimutkaisuus (pituus ja haarautumispisteet) eri ajoikkunoissa. ∗, ∗∗ ja ∗∗∗ tarkoittavat p < 0.05, p < 0.01 ja p < 0.001 verrattuna 0-21-juoksuryhmään Kruskal-Wallis-testin jälkeen, jota seuraa Dunnin post hoc -testi. Minkään 7 päivän juoksuryhmän välillä ei havaittu eroja. Näytemäärät (neuronit/hiiri): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) ja 15/3 (0-21). Vaakapalkit tarkoittavat keskiarvoa ± SEM. Avoimet ympyrät vastaavat esimerkkineuroneja.
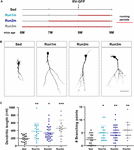
KUVIO 2. Neuroneja, jotka eivät toimi. Juoksun vaikutukset eri neuronikohortteihin. (A) Koejärjestely. RV-GFP-injektiota seurasi 3 viikon juoksu ja sitä edelsi istumatyöolosuhteet (Run1m), 1 (Run2m) tai 2 kuukauden juoksu (Run3m). Kaikkia ryhmiä verrattiin istuviin hiiriin (Sed). Dendriittien kokonaispituus analysoitiin 21 dpi:ssä. (B) Edustavat konfokaalikuvat GFP-GCs. Mittakaavapalkki, 50 μm. (C) Dendriittinen monimutkaisuus (pituus ja haarautumispisteet) eri juoksuikkunoissa. ∗, ∗∗ ja ∗∗∗ tarkoittavat p < 0.05, p < 0.01 ja p < 0.001 verrattuna Sediin Kruskal-Wallisin testin jälkeen, jota seuraa Dunnin post hoc -testi. Näytekoot (neuronit/hiiri): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) ja 15/3 (Run3m). Vaakapalkit tarkoittavat keskiarvoa ± SEM. Avoimet ympyrät vastaavat esimerkkineuroneja.

KUVIO 3. Esimerkkineuronit. Kroonisen liikunnan pysyvät vaikutukset. (A) Koejärjestely. RV-GFP-injektiota seurasi 3 viikon juoksu (Run1m) tai sitä edelsi 1 kuukauden harjoitus (Run-1m) tai 1 kuukauden harjoitus ja 1 kuukausi ilman juoksupyörää (Run-2m). Kaikkia ryhmiä verrattiin istuviin hiiriin (Sed). Dendriitin kokonaispituus analysoitiin 21 dpi:ssä. (B) Edustavat konfokaalikuvat leimatuista GC:istä. Mittakaavapalkki, 50 μm. (C) Dendriittinen monimutkaisuus (pituus ja haarautumispisteet) eri juoksuikkunoissa. ∗∗∗ tarkoittaa p < 0.001 verrattuna Sediin Kruskal-Wallisin testin jälkeen, jota seuraa Dunnin post hoc -testi. Näytekoot (neuronit/hiiri): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) ja 18/3 (Run-2m). (D) MFB-morfologia CA3:ssa analysoitiin Run1m- ja Run-1m-ryhmistä ja verrattiin Sediin. Edustavat konfokaalikuvat. Mittakaavapalkki, 5 μm. (E) ∗ ja ∗∗ tarkoittavat p < 0.05 ja p < 0.01 Kruskal-Wallisin testin jälkeen, jota seurasi Dunnin post hoc -testi. Näytekoot: 27/4 (Sed), 32/4 (Run1m) ja 18/4 (Run-1m). Vaakapalkit tarkoittavat keskiarvoa ± SEM. Avoimet ympyrät vastaavat esimerkkiboutoneja.
Immunofluoresenssi
Immunovärjäys tehtiin 60-μm:n vapaasti kelluville koronaalisille leikkauksille. Vasta-aineet levitettiin tris-puskuroituun suolaliuokseen (TBS), jossa oli 3 % aasiseerumia ja 0,25 % Triton X-100:aa. Immunofluoresenssi suoritettiin käyttämällä anti GFP:tä (kanin polyklonaalinen; 1:500; Invitrogen), anti NeuN:ää (hiiren monoklonaalinen; 1:50; lahja F.H. Gagelta, Salk Institute for Biological Studies, La Jolla, CA, Yhdysvallat), aasinvastaista kanin Cy3- ja aasinvastaista hiiren Cy5-vasta-aineita (1:250; Jackson Immuno Research Laboratories).
Konfokaalinen mikroskooppi
Dendriittisen pituuden mittauksia varten kuvat hankittiin (40 ×; NA 1.3; öljy-immersio) 60-μm paksuista leikkauksista, jotka ottivat Z-pinoja, jotka sisälsivät 35-50 optista viipaletta, ilmava yksikkö = 1 0.8-μm välein (Trinchero et ai.., 2017). Dendriittinen pituus mitattiin sitten LSM Image Browser -ohjelmistolla kolmiulotteisten rekonstruktioiden projektioista yhdelle tasolle GFP:tä ilmentävissä GC:ssä. Kuvat GFP-merkityistä MFB:istä CA3-alueella otettiin 0,4-μm:n välein (63×; NA 1,4; öljyimmersio) ja digitaalinen zoomaus 6. Filopodioiden pinta-ala ja lukumäärä analysoitiin kolmiulotteisten rekonstruktioiden projektioista yhteen tasoon. Kvantifiointia varten valittiin sammaloituneet kuitupäät (MFB), jotka täyttivät seuraavat kriteerit: (i) boutonin läpimitta oli >kolme kertaa suurempi kuin kuidun läpimitta, (ii) boutoni oli liitetty sammaloituneeseen kuituun ainakin toisesta päästä (Toni et al., 2008). Filopodiat tunnistettiin suurista sammalpäätteistä (1 μm < pituus < 20 μm) lähteviksi ulokkeiksi (Acsady ym., 1998). Filopodien ulokkeet mitattiin laskemalla ulokkeiden lukumäärä terminaalia kohti. Kuvien ottamista ja morfologisten ominaisuuksien analysointia varten kaikki tutkittavat koeryhmät olivat sokeita operaattorille.
Statistinen analyysi
Jollei toisin mainita, tiedot esitetään keskiarvoina ± SEM. Normaalisuutta arvioitiin Shapiro-Wilksin testillä, D’Agostino-Pearsonin omnibus-testillä ja Kolmogorov-Smirnovin testillä p-arvon ollessa 0,05. Kun tiedot täyttivät normaalisuustestit (Gaussin jakauma ja yhtäläinen varianssi), käytettiin parittelematonta t-testiä Welchin korjauksella tai ANOVAa Bonferronin post hoc -testillä. Tapauksissa, jotka eivät täyttäneet normaalisuutta, käytettiin ei-parametrisia testejä seuraavasti:
Tulokset
Olemme aiemmin osoittaneet, että juokseminen nopeuttaa uusien GC: iden kehitystä ja toiminnallista integroitumista ikääntyvässä hippokampuksessa (Trinchero et ai., 2017). Tutkimme nyt, vaatiiko tämäntyyppinen plastisuus pysyvää aktiivisuuden tasoa, joka kertyy ajan myötä, vai voivatko lyhyemmät juoksujaksot käynnistää myös nopeamman integroinnin, kuten aiemmin havaittiin EE: lle altistumisen yhteydessä (Trinchero et ai., 2019). Tämän kysymyksen käsittelemiseksi uudet neuronaaliset kohortit merkittiin keski-ikäisissä hiirissä (8 kuukauden ikäiset; 8M) käyttämällä GFP: tä ilmentävää retrovirusta (RV-GFP). Hiiret saivat käyttää juoksupyörää 1 viikon ajan neuronaalisen kehityksen eri ikkunoissa tai juosta koko neuronaalisen kasvun ajanjakson ajan (3 viikkoa; Kuvat 1A, B). Kuten aiemmin on kuvattu, uudet GC:t osoittivat hidasta kehitystä istuvilla hiirillä, mikä johti lyhyisiin dendriitteihin, joilla oli vähän haarautumia 3 viikossa. Yhden viikon juoksu ei muuttanut uusien GC:iden yleistä ulkonäköä millään testatulla aikavälillä (kuvat 1C,D). Sitä vastoin juokseminen koko 3-viikkoisen intervallin ajan johti dendriittien pituuden ja haarautumisen lisääntymiseen, mikä on johdonmukaista kiihtyneen neuronaalisen integraation kanssa.
Havaitut liikunnan vaikutukset testattiin yhdellä ainoalla neuronaalisella kohortilla, joka oli retroviralisesti leimattu. Koska uusia GC:itä syntyy kuitenkin jatkuvasti, on ajateltavissa, että aktiivisuus saattaa vaikuttaa myös eri hetkinä harjoitusjakson aikana syntyneisiin GC:iin. Tämän hypoteesin testaamiseksi käytimme yksinkertaista strategiaa eri aikoina syntyneiden neuronaalisten kohorttien merkitsemiseksi liikunnan aloittamisen suhteen altistamalla hiiret juokseville pyörille eri aikaväleille, mutta analysoimalla aina neuronaalista rakennetta 3 viikkoa retrovirusinjektion jälkeen (yksinkertaisuuden vuoksi nimetty 1m). Näin verrattiin kolmea kohorttia; yksi juoksi 3 viikkoa, leimattu heti liikunnan alkaessa (Run1m), yksi juoksi 2 kuukautta, leimattu 1 kuukausi liikunnan alkamisen jälkeen (Run2m), ja yksi juoksi 3 kuukautta, leimattu 2 kuukautta liikunnan alkamisen jälkeen (Run3m) (Kuva 2A). Havaitsimme kaikissa olosuhteissa samanlaista hermosolujen kasvua verrattuna istumatyötä tekeviin hiiriin, mikä osoittaa, että kaikki vapaaehtoista juoksua suorittavan keski-ikäisen hiiren aivoissa syntyvät hermosolukohortit kasvavat ja integroituvat nopeasti (kuvat 2B, C). Run3m-hiirten GC-hiirten dendriittipuut olivat hieman pidempiä kuin Run1m- tai Run2m-hiirten hiirten GC-hiirten dendriittipuut, mikä viittaa siihen, että neuronaalisen integraation edistäminen saattaa vastata mekanismiin, jonka vaikutus kumuloituu ajan myötä. Silti 1 kuukauden juoksu johti lähes maksimaaliseen vaikutukseen GC-kehitykseen.
Tutkimme sitten liikunnan vaikutuksia ikääntyvissä aivoissa neuronaalisiin kohortteihin, jotka syntyivät, kun aktiivisuus päättyi. Vertasimme, miten 3-4 viikkoa kestänyt juoksu vaikuttaa uusien GC:iden kehitykseen, jotka syntyvät heti alussa (Run1m), lopussa (Run-1m) tai 1 kuukausi harjoituksen päättymisen jälkeen (Run-2m; Kuva 3A). Yllättäen juoksujakson alussa tai lopussa syntyneet neuronikohortit vastasivat samalla tavalla (kuvat 3B,C). Sitä vastoin kohortit, jotka syntyivät 1 kuukausi harjoituksen päättymisen jälkeen (Run-2m), osoittivat vain hienovaraista vaikutusta.
Täysin integroituakseen piiriin GC:t luovat glutamatergisia eksitatorisia yhteyksiä CA3-pyramidisoluihin suurten MFB:iden välityksellä ja rekrytoivat pyramidisoluihin GABAergista feedforward-inhibitiota pyramidisoluihin filopodiaalisten jatkeiden välityksellä, jotka syntyvät kyseisistä päätelaitteista (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Vaikka konfokaalianalyysi ei paljastanut muutoksia Run-1m- tai Run1m-hetkellä syntyneiden neuronien MFB:ien pinta-alassa kontrolleihin verrattuna, filopodioiden / MFB:ien määrä kasvoi ∼100 % (kuvat 3D, E). Nämä tulokset osoittavat, että fyysinen harjoittelu lisää erityisesti yhteyksiä uusista GC:istä inhiboivaan paikallisverkkoon (Trinchero et ai., 2019).
Keskustelu
Aikuisten neurogeneesi käsittää monimutkaisten kehitysvaiheiden sarjan, jonka tuloksena on uusien informaatiota prosessoivien yksiköiden integrointi. Subgranulaarisen vyöhykkeen neuraaliset kantasolut lähtevät rauhallisesta tilastaan ja muuttuvat proliferoiviksi neuraalisiksi progenitorisoluiksi, jotka laajentavat esiasteiden populaatiota (kauttakulkua monistavat solut) (Bonaguidi ym., 2012). Progenitorisolut tuottavat neuroneja, jotka vaeltavat, kehittyvät ja integroituvat piiriin. Tämän pidennetyn aikaikkunan aikana neuronipoolin määrä vähenee huomattavasti apoptoottisen solukuoleman vuoksi. Vapaaehtoinen liikunta ja EE ovat voimakkaita ärsykkeitä, jotka lisäävät aikuisten hippokampuksen neurogeneesiä jyrsijöillä koko elämän ajan (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Neurogeneesi vähenee ikääntyvissä aivoissa, mikä johtuu pääasiassa esisolupoolin koon pienenemisestä. Sekä juoksu että EE voivat torjua ikääntyvillä eläimillä raportoitua vähentynyttä hermosolutuotantoa eri mekanismien kautta (Kempermann ym., 2010). Juokseminen vaikuttaa kahdella tasolla tehostaen neurogeneesiä: se lisää hermoston esisolujen proliferaationopeutta (van Praag ym., 1999b, 2005; Cooper ym., 2018) ja nopeuttaa kehittyvien neuronien kypsymistä ja toiminnallista integroitumista (Trinchero ym., 2017). EE lisää eloonjäämistä ja nopeuttaa myös uusien GC-solujen kypsymistä, mutta se ei vaikuta proliferaatioon (Trinchero et al., 2017, 2019).
Juoksu edistää myös hermosolujen yhteyksien uudelleenkytkentää ja sisäisten ominaisuuksien modulaatiota uusissa GC-soluissa kehityksen ensimmäisen viikon aikana nuorilla aikuisilla hiirillä (Sah et al., 2017). Olemme äskettäin raportoineet kriittisen ajanjakson GC-kypsymisen toisella viikolla ikääntyvillä eläimillä, jolloin EE indusoi dendriittistä kasvua ja uusien neuronien nopeampaa integroitumista piiriin (Trinchero et ai., 2019). Kysyimme tässä, vaikuttaisiko 1 viikon juokseminen milloin tahansa GC-kehityksen aikana niiden integroitumiseen, mutta emme havainneet mitään vaikutusta (Kuva 1). Neurogeneesin säätelyyn tarvittiin koko 3 viikon juoksuaika. Lyhytaikaisen moduloinnin puuttuminen viittaa mekanismiin, jota välittävät tekijät, joiden on kasaututtava, jotta ne voivat aiheuttaa havaittavia muutoksia. Mielenkiintoista on, että vapaaehtoinen liikunta pahentaa BDNF: n tuotantoa, joka kerääntyy viikkojen aikana ennen kuin se saavuttaa tasotason, joka harjoittaa maksimaalisia vaikutuksia (Vecchio et ai., 2018). Vaikka neurotrofiinit ovat keskeisiä välittäjiä, tässä havaitut vaikutukset on uskottavaa, että niitä välittävät useat mekanismit. Liikunta lisää myös sähköistä aktiivisuutta dentate gyrusissa, nostaa verenkiertoa ja moduloi neuroinflammaatiota (Piatti et ai., 2011; Speisman et ai., 2013; Trinchero et ai., 2017). Muiden mekanismien osuus vaatii lisätutkimuksia.
Näytämme tässä, että ∼3-viikon ikäisten hiirten ∼3-viikon ikäiset GC:t, jotka altistuvat kroonisesti juoksevalle pyörälle (jopa 3 kuukautta), esittävät täysin kehittyneen fenotyypin, jossa on pitkät ja monimutkaiset dendriittiset arborisaatiot, jotka ovat samankaltaisia kuin nuorissa aikuisissa hiirissä syntyneissä uusissa GC: ssä (kuva 2). Nuorten aikuisten ja keski-ikäisten hiirten kypsät GC:t saavuttavat kehityksen loppuun mennessä vastaavan dendriittisen pituuden ja monimutkaisuuden, joka on verrattavissa 3 viikkoa vanhoihin GC:iin ikääntyvissä hiirissä, jotka altistuvat EE: lle tai juoksemiselle (Piatti et ai., 2011; Trinchero et ai., 2017, 2019). Tämä kertynyt todistusaineisto puhuu juoksun aiheuttaman kypsymisnopeuden selkeästä kiihtymisestä.
Neuronaalisen ulostulon tasolla juoksu edisti filopodiaalisten jatkeiden nopeaa kasvua, mutta ei muuttanut MBF:ien kokoa (kuvat 3D,E). Tämä tulos viittaa siihen, että uudet GC:t integroituvat nopeasti, mutta niiden tuotos saattaa olla puolueellisesti suuntautunut GABAergisten interneuronien aktivointiin CA3:ssa (joihin filopodiat ottavat yhteyttä) pikemminkin kuin pyramidisoluihin, joihin MFB:t ottavat yhteyttä (Acsady et ai., 1998; Toni et ai., 2008; Sun et ai., 2013; Restivo et ai., 2015). On yllättävää, että EE aiheutti ikääntyvillä hiirillä sekä MFB: iden koon että filopodiaalisten jatkeiden määrän merkittävän kasvun, mikä on johdonmukaista hermosolujen tuoton tasapainoisemman moduloinnin kanssa (Trinchero et ai., 2019). Spekuloimme, että EE: n aiheuttamiin muutoksiin liittyy aktiivisuudesta riippuvainen tiettyjen synapsien uudelleenmuotoilu, jotka vahvistuvat avaruudellisten vihjeiden koodaamiseksi (Nicoll ja Schmitz, 2005; Holtmaat ja Svoboda, 2009). Sitä vastoin juokseminen voi edustaa yleistä ärsykettä uusille GC: ille, jotka valmistautuvat liittymään tiettyihin kohteisiin, kun koodaus tulee tarpeelliseksi, säilyttäen samalla GABAergisten interneuronien estävän sävyn, joka saattaa toimia mekanismina, joka rajoittaa postsynaptista aktiivisuutta, kunnes uusi GC on kunnolla koottu ympäröivään verkkoon.
Tuloksemme viittaavat siihen, että ikääntyvät aivot synnyttävät neurogeenisiä signaaleja, kun hiiret jatkavat juoksemista pitkiä aikoja (kuukausia). Tässä yhteydessä juoksevissa hiirissä syntyvät myöhemmät neuronikohortit kehittyvät ja integroituvat nopeasti, jolloin ikääntyvät piirit voivat kerätä huomattavan määrän uusia neuroneja (kuva 4). Uusien GC:iden jatkuva sisällyttäminen, joilla on ominaisuuksia, jotka muistuttavat sitä, mitä tapahtuu nuoremmilla hiirillä, johtaa nuorentuneeseen hippokampukseen, jossa on neuroneja, jotka voidaan pohjustaa vastaamaan tuleviin kokemuksiin.
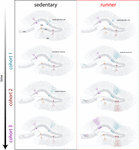
Kuvio 4. Juoksun aiheuttama hippokampusverkon nuorentaminen keski-ikäisillä hiirillä. Kaavamainen esitys neuronaalisen integraation ajallisesta kulusta istuvilla (vasemmalla) ja juoksevilla (oikealla) hiirillä pitkien vapaaehtoisten liikuntajaksojen jälkeen. Dentate gyrusin subgranulaarisessa vyöhykkeessä radial-glian kaltaiset solut (RGL) pysyvät rauhallisessa tilassa (ylhäällä). Istumatta vanhenevilla hiirillä neurogeneesi on vähäistä, ja uudet hermosolut kehittyvät hitaasti (edustavat kohortit on merkitty eri väreillä). Juoksevilla hiirillä uusien GC-solujen tuotanto kiihtyy, ja nämä uudet yksiköt kehittyvät ja integroituvat nopeammin, mikä laajentaa hermoverkkoa kumulatiivisesti pidemmän ajan kuluessa. Lopulta nämä täysin kypsien neuronien uudet kohortit sitoutuvat käsittelemään tietoa tarpeen mukaan.
Laaja-alaisesta näkökulmasta katsottuna nykyaikaiseen yhteiskuntaan liittyvään pitkäikäisyyden lisääntymiseen liittyy suurempi kognitiivisen heikkenemisen riski. Näin ollen on tärkeää ymmärtää mekanismeja, jotka ovat liikunnan tunnettujen hyötyjen taustalla aivotoiminnassa. Lisäksi eri elämänvaiheissa liikuntaa harrastavien ja jatkuvasti liikuntaa harrastaneiden henkilöiden välillä saattaa olla pitkäaikaisia eroja neurodegeneratiivisten sairauksien kehittymisriskin vähentämisessä (Llorens-Martin, 2018). Tuloksemme osoittavat, että jatkuva juoksu edistää monien hermosolukohorttien integroitumista, mikä nostaa verkon monimutkaisuutta huomattavalla tavalla. Erilaisten strategioiden suunnittelu uusien neuronien integraation tehokkuuden lisäämiseksi hippokampuksessa saattaa toimia lupaavana plastisuusmekanismina, jolla voidaan lopulta lievittää kognitiivista heikkenemistä, jota esiintyy terveissä ja sairaissa ikääntyvissä aivoissa. Lopuksi tällaisen nopeutetun neuronien integroinnin ja kehityksen eri näkökohtien taustalla olevien mekanismien analysointi opettaa meille paljon hermoverkkojen plastisuuden mahdollisuuksista ikääntyvissä aivoissa.
Tietojen saatavuus
Tämän tutkimuksen tuloksia tukevat tiedot ovat saatavissa vastaavalta kirjoittajalta perustellusta pyynnöstä.
Eettinen lausunto
Leloir-instituutin koe-eläinten käyttöä ja hoitoa käsittelevä komitea on tarkastanut ja hyväksynyt eläintutkimuksen.
Tekijöiden panos
MT ja MH suorittivat kokeet ja analysoivat tiedot. MT, MH ja AS suunnittelivat kokeet ja kirjoittivat käsikirjoituksen. AS antoi taloudellista tukea.
Rahoitus
Tätä työtä ovat tukeneet Argentiinan tieteen ja teknologian edistämisvirasto (Grant# PICT2015-3814), kansallinen neurologisten häiriöiden ja aivohalvauksen instituutti (National Institute of Neurological Disorders and Stroke) ja Fogarty International Center (Grant# R01NS103758) AS:lle, joka on tutkijana Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT:tä tuettiin CONICET:n apurahalla.
Irintaristiriitojen selvitys
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Kiitämme AS:n laboratorion jäseniä oivaltavista keskusteluista.
Acsady, L., Kamondi, A., Sik, A., Freund, T. ja Buzsaki, G. (1998). GABAergiset solut ovat tärkeimmät sammalkuitujen postsynaptiset kohteet rotan hippokampuksessa. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., ja Das, G. D. (1965). Autoradiografiset ja histologiset todisteet postnataalisesta hippokampuksen neurogeneesistä rotilla. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., ja Wulff, P. (2015). Hippokampus ikääntymisessä ja sairaudessa: plastisuudesta haavoittuvuuteen. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). Yhdistävä hypoteesi nisäkkäiden neuraalisten kantasolujen ominaisuuksista aikuisen hippokampuksessa. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., ja Barnes, C. A. (2006). Neuraalinen plastisuus ikääntyvissä aivoissa. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., ja Moser, E. I. (2013). Muisti, navigointi ja theta-rytmi hippokampus-entorinaalijärjestelmässä. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). Hippokampuksen plastisuuden jäljillä. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., ja Sendtner, M. (2016). Voiko liikunta vanhuudessa parantaa muistia ja hippokampuksen toimintaa? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., ym. ym. (1998). Neurogenesis in the adult human hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). Hippokampuksen ikääntymisen mekanismit ja nuorennusmahdollisuudet. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J. ja Toni, N. (2013). Aikuisten hippokampuksen neurogeneesi korreloi käänteisesti mikroglian kanssa vapaaehtoisen juoksun ja ikääntymisen olosuhteissa. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., ja Svoboda, K. (2009). Kokemuksesta riippuvainen rakenteellinen synaptinen plastisuus nisäkkäiden aivoissa. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Juokseminen vähentää stressiä ja parantaa solujen syntyä ikääntyneillä hiirillä. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Miksi ja miten fyysinen aktiivisuus edistää kokemuksen aiheuttamaa aivojen plastisuutta. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., ja Gage, F. H. (1998). Kokemuksen aiheuttama neurogeneesi vanhenevassa dentate gyrusissa. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D. ja Kempermann, G. (2006). Fyysinen harjoittelu ehkäisee ikään liittyvää esiasteiden solujen aktiivisuuden vähenemistä hiiren dentate gyrusissa. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Aikuisen hippokampuksen proliferoivien solujen osapopulaatiot reagoivat eri tavoin fysiologisiin neurogeenisiin ärsykkeisiin. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., ja Gage, F. H. (1996). Neurogeneesi aikuisen rotan dentate gyrusissa: ikään liittyvä neuronaalisen progenitorin proliferaation väheneminen. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Uusien hermosolujen harjoittaminen Alzheimerin taudin voittamiseksi. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Juokseminen koko keski-iässä parantaa muistitoimintoja, hippokampuksen neurogeneesiä ja BDNF-tasoja naaraspuolisilla C57BL/6J-hiirillä. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Hippokampuksen neurogeneesiä ei tarvita ympäristön rikastamisen käyttäytymisvaikutuksiin. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., ym. et al. (2019). Aikuisten hippokampuksen neurogeneesi on runsas neurologisesti terveillä koehenkilöillä ja vähenee jyrkästi Alzheimerin tautia sairastavilla potilailla. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G. ja Schinder, A. F. (2008). Vastasyntyneet granulussolut ikääntyvässä dentate gyrusissa. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). Synaptinen plastisuus hippokampuksen sammalkudossynapseissa. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., ja Kelly, A. M. (2009). Pitkäaikainen juoksumattoaltistus suojaa rotan hippokampuksen ikään liittyviltä neurodegeneratiivisilta muutoksilta. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). Hiiren aivot stereotaksisissa koordinaateissa. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). Aikuisen hippokampuksen hermosolujen kypsymisen ajoitusta moduloi paikallinen verkkoaktiivisuus. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A. ja Frankland, P. W. (2015). Aikuisten soluyhteyksien kehittyminen eksitatoristen ja inhiboivien solupopulaatioiden kanssa hippokampuksessa. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C. ja van Praag, H. (2017). Juokseminen järjestää uudelleen viikon ikäisten aikuissyntyisten hippokampuksen neuronien piiriä. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Rani, A., Foster, T. C., ja Ormerod, B. K. (2013). Päivittäinen liikunta parantaa muistia, stimuloi hippokampuksen neurogeneesiä ja moduloi immuuni- ja neuroimmuunisytokiineja ikääntyvillä rotilla. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Ehjien aikuissyntyisten neuronien saumaton rekonstruktio sarjoittaisella pääteblokkikuvantamisella paljastaa monimutkaisen aksonien ohjauksen ja kehityksen aikuisen hippokampuksessa. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Aikuisen dentate gyrusissa syntyneet neuronit muodostavat toiminnallisia synapseja kohdesolujen kanssa. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., ym. et al. (2017). Uusien rakeisten solujen suuri plastisuus ikääntyvässä hippokampuksessa. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C. ja Schinder, A. F. (2019). Kokemuksesta riippuvainen aikuissyntyisten neuronien rakenteellinen plastisuus ikääntyvässä hippokampuksessa. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., ja Gage, F. H. (1999a). Juokseminen parantaa neurogeneesiä, oppimista ja pitkäaikaista potentiaatiota hiirillä. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., ja Gage, F. H. (1999b). Juokseminen lisää solujen lisääntymistä ja neurogeneesiä aikuisen hiiren dentate gyrusissa. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., ja Gage, F. H. (2005). Liikunta parantaa oppimista ja hippokampuksen neurogeneesiä ikääntyneillä hiirillä. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C. ja Aubert, I. (2018). Liikunnan neuroprotektiiviset vaikutukset: terveiden aivojen ylläpitäminen läpi ikääntymisen. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Liikunta lisää neuraalisten kantasolujen proliferaatiota ja neuriinien kasvua sekä neuronaalisten esiasteen solujen selviytymistä keski-ikäisten hiirten dentate gyrusissa. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., and Hen, R. (2015). Juokseminen pelastaa pelkoon perustuvan kontekstuaalisen erotteluvajeen ikääntyneillä hiirillä. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Juoksun aiheuttama muistin paraneminen korreloi ohuiden selkärankojen säilymisen kanssa vanhojen C57BL / 6 -hiirten hippokampuksen CA1-alueella. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




