Frontiers in Oncology
Introduction
Glioblastooma ja anaplastinen astrosytooma (ANA) ovat kaksi yleisintä primaarista aivokasvainta aikuisilla (1). Esiintyvyys on todella lisääntynyt erityisesti iäkkäillä (1-3). Kliinisessä käytännössä on vaikeaa erottaa glioblastoomapotilaat ANA-potilaista ennen leikkausta tai biopsiaa, koska näiden kahden kasvaimen oireet ja merkit ovat suhteellisen yhtenäisiä ja epäspesifisiä (4, 5). Niiden hoito on kuitenkin erilaista, kuten kemoterapiaprotokolla, annostus ja antotapa (6). Esimerkiksi ANA-potilaille (WHO-luokka III) suositellaan sädehoitoa tai TMZ:tä resektion tai biopsian jälkeen, kun taas potilaille, joilla on hiljattain diagnosoitu glioblastooma (WHO-luokka IV), suositellaan sädehoitoa ja samanaikaista TMZ:tä, jota seuraa adjuvantti TMZ. Aiempien tutkimusten mukaan glioblastooma ja ANA kasvavat tunkeutumalla normaaliin aivokudokseen, leviävät aivo-selkäydinnesteen (CSF) kautta ja ulottuvat yksittäisen kaulavaltimon tai nikamavaltimon levinneisyysalueen ulkopuolelle, joten ne molemmat reagoivat huonosti lääkehoitoon ja niistä on tullut johtavia syöpäkuolemien syitä aikuisilla (7, 8). Lisäksi glioblastooman ja ANA:n ennuste on erilainen. Ikääntyneessä väestössä glioblastooman ja ANA:n välillä ei ole merkittävää eroa ennusteessa, mutta nuoremmassa väestössä eroa voi olla (9). Siksi on vaikeaa mutta ratkaisevan tärkeää erottaa glioblastooma ANA:sta.
Magneettiresonanssikuvaus (MRI) on optimaalinen neurokuvantaminen glioblastooman ja ANA:n preoperatiivisessa diagnosoinnissa sen monitasoisen kyvykkyyden ja erinomaisen pehmytkudoskontrastin vuoksi. Vaikka joissakin tutkimuksissa osoitettiin, että rengasmaisen tehostumisen ja nekroosin esiintyminen viittaa glioblastoomaan, useimmissa tapauksissa sekä glioblastooma että ANA näkyvät magneettiresonanssikuvissa epäsäännöllisinä muotoina (T2-painotteisessa sekvenssissä hypertensiivisinä ja T1-painotteisessa sekvenssissä hypodensiivisinä), joissa on eriasteista Gd-pohjaista kontrastin voimistumista ja turvotusta, joista erot olivat yleensä ihmissilmälle huomaamattomia (10-12).
Viime aikoina tekstuurianalyysia (TA), joka tunnetaan myös nimellä radiomiikka, on sovellettu laajasti eri aloilla. Tutkijat havaitsivat, että TA oli toteuttamiskelpoinen ja lupaava menetelmä erotusdiagnoosin helpottamiseksi, koska sen avulla MR-kuvista voitiin hankkia kvantitatiivista lisätietoa, joka oli ihmisen arvioinnille näkymätöntä (13-15). TA kuvaa voxel-arvon taajuusjakaumaa ja spatiaalista organisaatiota paljastaakseen mahdolliset erot kasvainkudoksessa (16). Aiemmissa tutkimuksissa on selvitetty TA:n soveltuvuutta erotusdiagnostiikkaan, kasvainten alatyyppien luokitteluun ja kasvainkudoksen heterogeenisuuden havaitsemiseen (17-19). Tietojemme mukaan TA:n soveltamisesta glioblastooman ja ANA:n erotusdiagnostiikassa ei ole vielä raportoitu. Tämän tutkimuksen tarkoituksena oli arvioida MRI-tekstuurianalyysin erottelukykyä koneoppimisalgoritmien avulla glioblastooman ja ANA:n erottamiseksi toisistaan.
Materiaalit ja menetelmät
Potilaiden valinta
Etsimme retrospektiivisesti laitoksemme tietokannasta ja seuloimme kaikki potilaat, jotka diagnosoitiin histopatologisesti glioblastoomaksi tai ANA:ksi, tammikuusta 2015 joulukuuhun 2018. Kelvollisten potilaiden kelpoisuuskriteerit olivat: (1) vakuuttava histopatologinen diagnoosi glioblastoomasta tai ANA:sta; (2) tarkat sähköiset potilastiedot, erityisesti patologinen materiaali; (3) diagnostinen MR-kuvaus laitoksessamme ennen kirurgista resektiota. Poissulkukriteerit olivat: (1) kallonsisäisen sairauden historia (esim. aivovamma, kallonsisäinen infektio tai muun tyyppinen aivokasvain), ottaen huomioon arpikudoksen häiritsevyys kuvien intensiteetissä; (2) liikeartefaktien esiintyminen magneettikuvauksessa; (3) aiemmat hoitokäsittelyt ennen magneettikuvausta (esim. leikkaus, kemoterapia tai sädehoito); (4) potilaat, jotka eivät saavuttaneet kriteerejä glioblastooma- tai ANA-diagnoosin diagnosoimiseksi WHO:n 2016-luokitusjärjestelmän mukaisesti. Vanhempi neuropatologi, jolla oli 10 vuoden kokemus, arvioi, täyttikö potilas glioblastooman tai ANA:n kriteerit (WHO:n vuoden 2016 luokitusjärjestelmä). Laitoksen arviointilautakunta hyväksyi tämän retrospektiivisen tutkimuksen. Tähän tutkimukseen osallistuneilta osallistujilta saatiin kirjallinen tietoinen suostumus. Sichuanin yliopiston eettinen komitea ja laitoksemme radiologian osasto ovat hyväksyneet tilastojen hyödyntämisen tässä tutkimuksessa.
MR-kuvien hankinta
Kaikkien tähän tutkimukseen osallistuneiden potilaiden osalta oli käytettävissä kontrastinvahvistettuja T1-painotteisia sekvenssejä, ja ne saatiin 3.0T Siemens Trio -skannerilla seuraavilla parametreilla: TR/TE/TI = 1900/2,26/900 ms, kääntökulma = 9 °, 20 aksiaalista viipaletta, joiden paksuus = 5 mm, aksiaalinen FOV = 25,6 × 25,6 cm2 ja datamatriisi = 256 × 256. Kontrastia tehostetussa T1-painotteisessa kuvantamisessa käytettiin gadopentetaattidimeglumiinia (0,1 mmol/Kg) kontrastiaineena kontrastia tehostettuun kuvaan, ja kontrastia tehostetun magneettikuvauksen monisuuntaiset tiedot kerättiin yhtäjaksoisen 90-250 s:n intervallijakson aikana.
Tekstuurin uuttaminen
Tutkimuksessamme käytettiin LifeX-pakettia (http://www.lifexsoft.org) tekstuurin ominaisuuksien uuttamiseen. Kontrastin jälkeiset T1-painotteiset (T1C) kuvat valittiin jatkoanalyysiä varten, koska ne kuvaavat selkeästi kasvaimen sijainnin ja rajan (20). Kontrastivahvennetuissa kuvissa aksiaalitasoon piirrettiin manuaalisesti viipalekohtaisesti kiinnostuksen kohdealue (Region of Interest, ROI) kontrastivahvennetuissa kuvissa olevien leesioiden varrelle, jotta saatiin tekstuuripiirteitä. Kaksi kokenutta neurokirurgia, jotka olivat sokeita potilaiden potilastiedoille ja histopatologiselle diagnoosille, piirsivät ROI:n, jonka jälkeen vanhempi radiologi ja vanhempi neurokirurgi muokkasivat sitä. Erimielisyydet ratkaistiin keskustelemalla ja konsultoimalla vanhemman radiologin ja vanhemman neurokirurgin kanssa. MRI-kuvista poimittiin yhteensä 40 tekstuuriominaisuutta, mukaan lukien minValue, meanValue, maxValue, stdValue ja kuudesta matriisista johdetut parametrit: Histogrammipohjainen matriisi (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone length matrix (GLZLM) ja Neighborhood gray-level dependence matrix (NGLDM).
Features Selection
Tekstuuripiirteitä johdettiin kuudesta valitusta matriisista yhteensä 40 kappaletta. Selitys 40 tekstuuripiirteestä oli esitetty lisätaulukossa 1. Näiden tekstuuripiirteiden tilastot on esitetty lisätaulukossa 2. Ominaisuuksien valinta suoritettiin merkityksellisten ominaisuuksien määrittämiseksi ja siten ylisovittamisen välttämiseksi. Lisäksi tässä tutkimuksessa sovellettu koneoppimisalgoritmi ei voinut ottaa analyysiin kaikkia 40 tekstuuriominaisuutta. Optimaalisten tekstuuriominaisuuksien valitsemiseen käytettiin kolmea riippumatonta ominaisuuksien valintamenetelmää, mukaan lukien etäisyyskorrelaatio, pienin absoluuttinen kutistuma ja valintaoperaattori (LASSO) sekä gradienttikorrelaatiopäätöspuu (GBDT). Näin muodostettiin kolme tekstuuriominaisuuksien osajoukkoa, jotka muodostivat kolme erilaista tietokokonaisuutta.
Luokittelu
Lineaarinen diskriminaatioanalyysi (Linear Discriminant Analysis, LDA) on vankka luokittelumenetelmä, jonka avulla erotetaan kaksi luokkaa toisistaan etsimällä lineaarista yhdistelmää prediktoreista, joka maksimoi ryhmien välisen erottelun. Tässä tutkimuksessa laadittiin kolme LDA-algoritmiin perustuvaa luokittelumallia: Distance Correlation + LDA, LASSO + LDA ja GBDT + LDA. Aineistot syötettiin LDA-algoritmiin vastaavasti ja itsenäisesti. Kukin tietokokonaisuus jaettiin satunnaisesti harjoitus- ja validointiryhmään suhteessa 4:1. Koulutusryhmässä koulutettua mallia sovellettiin sitten riippumattomaan validointiryhmään sen suorituskyvyn arvioimiseksi. LDA-algoritmin kestävyyden arvioimiseksi menettely toistettiin 100 jakson ajan erilaisilla, satunnaisilla ja riippumattomilla tapausmäärityksillä. Sekaannusmatriisi määritettiin käyttämällä histopatologian todellista luokitusta ja LDA-algoritmin ennusteita. Standardiherkkyys, spesifisyys, vastaanottimen käyttöominaiskäyrän alaiset pinta-alat (AUC) ja tarkkuus laskettiin sekä koulutus- että validointiryhmälle mallien erottelukyvyn paljastamiseksi. Kolmea mallia (etäisyyskorrelaatio + LDA, LASSO + LDA ja GBDT + LDA) verrattiin toisiinsa optimaalisen erottelukykyisen mallin määrittämiseksi glioblastoomalle ja ANA:lle. MRI-luokittelun vuokaavio tekstuuriominaisuuksien avulla on esitetty kuvassa 1.
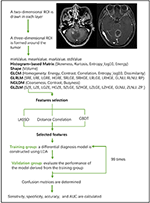
Kuva 1. Virtauskaavio MRI-luokittelusta tekstuuriominaisuuksien avulla.
Tulokset
Potilaiden ominaisuudet
Yhteensä 133 potilasta, joilla oli glioblastooma (n = 76) tai ANA (n = 57), täytti sisäänottokriteerit. Kaikki glioblastoomapotilaat otettiin mukaan tähän tutkimukseen, kun taas 10 ANA-potilasta suljettiin pois poissulkukriteerien mukaisesti. Lopulta 76 glioblastoomapotilasta ja 46 ANA-potilasta otettiin mukaan tähän tutkimukseen. Potilaiden keski-ikä oli 46,9 (15-67) ja 40,0 (7-69) vuotta. Kaikille potilaille tehtiin kasvaimen kirurginen resektio neurokirurgian osastollamme vuosina 2015-2018. Kuvassa 2 on esitetty kaksi tapausta kontrastinvahvistettujen kuvien aksiaalitasosta potilailla, joilla oli glioblastooma ja ANA.
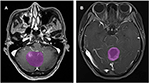
Kuva 2. Esimerkkejä kahdesta tapauksesta kontrastitehosteisista MR-kuvista potilailla, joilla on glioblastooma ja ANA. (A) Kontrastinvahvistetut kuvat ANA:n kanssa, (B) kontrastinvahvistetut kuvat glioblastooman kanssa. ANA, anaplastinen astrosytooma.
Glioblastooma vs. ANA
Tässä tutkimuksessa analysoitiin kolme mallia, mukaan lukien Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. Näissä malleissa luokittelussa käytetyt tekstuuriominaisuudet oli esitetty lisätaulukossa 3. Kunkin mallin suorituskyky on esitetty taulukossa 1 (mukaan lukien herkkyys, spesifisyys, tarkkuus ja AUC koulutus- ja validointiryhmän osalta). LASSO + LDA saavutti parhaan suorituskyvyn ja korkeimmat AUC-arvot sekä koulutus- että validointiryhmässä. Sen koulutusryhmän sensitiivisyys, spesifisyys, tarkkuus ja AUC olivat 0,989, 0,993, 0,996 ja 0,997, ja validointiryhmän sensitiivisyys, spesifisyys, tarkkuus ja AUC olivat 0,927, 0,989, 0,968 ja 0,974. Lisäksi etäisyyskorrelaatio + LDA ja GBDT + LDA osoittivat myös lupaavaa kykyä erottaa glioblastooma ANA:sta, AUC ≥0,95 sekä koulutusryhmissä että validointiryhmissä.

TAULUKKO 1. Glioblastooman ja ANA:n välinen erottelu.
Kuvassa 3 on esitetty LASSO + LDA -malleista saatujen kanonisten erottelufunktioiden suhde glioblastooma- ja ANA-ryhmille (kolmiot ja ympyrät) ja ryhmien sentroideille (neliöt). Tässä kuvassa havaittiin minimaalinen päällekkäisyys. Laadullisesti LASSO:lla valittujen tietojen analyysillä voitiin erottaa glioblastooma ANA:sta. Kuvassa 4 esitetään glioblastoomalle ja ANA:lle määritetyn suoran LDA-funktion jakauma yhdelle 100:sta riippumattomasta harjoitusjaksosta data-analyysissä havainnollistamaan LASSO + LDA -mallin suorituskykyä. LDA-funktion arvoissa oli selviä siirtymiä, ANA:n osalta siirtymä vasemmalle ja glioblastooman osalta siirtymä oikealle.
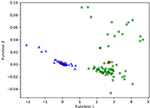
KUVIO 3. LDA-funktion arvot. LASSO + LDA -malleista saatujen kanonisten erotusfunktioiden suhde glioblastooma- ja ANA-ryhmien (kolmiot ja ympyrät) sekä ryhmien keskipisteiden (neliöt) välillä. Tässä kuvassa havaittiin minimaalinen päällekkäisyys. Laadullisesti LASSO:lla valittujen tietojen analyysillä voitiin erottaa glioblastooma ANA:sta. LASSO, least absolute shrinkage and selection operator; LDA, lineaarinen diskriminaatioanalyysi; ANA, anaplastinen astrosytooma.
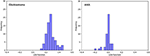
KUVIO 4. Goblastooma. Glioblastoomalle ja ANA:lle määritetyn suoran LDA-funktion jakauma yhdelle 100:sta riippumattomasta harjoittelujaksosta data-analyysissä, joka havainnollistaa LASSO + LDA -mallin suorituskykyä. LDA-funktion arvoissa oli selviä siirtymiä, ANA:n osalta vasemmalle ja glioblastooman osalta oikealle. Kahden ryhmän välillä on havaittavissa minimaalinen päällekkäisyys, ja syklien ja kolmioiden kuvaajien välillä on havaittavissa vahva laadullinen samankaltaisuus. LDA, lineaarinen diskriminaatioanalyysi; ANA, anaplastinen astrosytooma; LASSO, pienimmän absoluuttisen kutistuman ja valintaoperaattori.
Keskustelu
Glioblastooman ja ANA:n hoitoa edeltävä erotusdiagnostiikka on tärkeää, kun otetaan huomioon hoitostrategian ja potilaiden ennusteen merkittävä ero. MR-tutkimus, aivokasvainten tärkein radiologinen preoperatiivinen tutkimus, on erittäin suositeltava, koska sen herkkyys vaurion havaitsemisessa on hyvä. Tarkka diagnoosi ennen leikkausta on kuitenkin edelleen haastavaa, koska molemmilla kasvaimilla on tavanomaisissa magneettikuvauksissa samankaltaisia ominaisuuksia, joita ihminen ei pysty arvioimaan paljain silmin (4, 5). Tässä tutkimuksessa poimimme kuvien kvantitatiivisen kuvauksen tekeviä tekstuuriominaisuuksia maksimoidaksemme MR-tutkimuksen hyödyntämisen, jonka avulla luotiin kolme LDA-pohjaista mallia. Tulokset osoittivat, että MRI-pohjainen tekstuurianalyysi yhdistettynä LDA-algoritmiin voisi mahdollistaa toteutettavissa olevan erottelun glioblastooman ja ANA:n välillä.
TA on matemaattinen lähestymistapa, jolla voidaan luonnehtia vokseliarvon heterogeenisuutta kuvissa. Se voisi visualisoida spatiaalisen histologisen heterogeenisuuden, joka on ihmissilmän arvioinnille näkymätön (21). Teoriassa leesioiden kuvien ominaisuuksia voitaisiin analysoida kvantitatiivisesti tekstuurin ominaisuuksina, koska niiden erilaiset vahvistetut kuviot MR-kuvissa ovat erilaisia (22). Lisäksi aiemmissa tutkimuksissa on ehdotettu, että tekstuuriominaisuudet voisivat heijastaa useita kasvaimen epänormaaleja patologisia prosesseja, kuten turvotusta, effuusiota ja nekroosia, mikä tarjoaa tekstuuriominaisuuksille potentiaalisen mekanismin glioblastooman erottamisessa ANA:sta (23, 24).
Tekoälyä on tutkittu laajasti viimeaikaisissa tutkimuksissa. Yhdistettynä kuvista poimittuihin tekstuuriominaisuuksiin sen on raportoitu auttavan kasvaimen luokittelussa, kliinisessä diagnoosissa ja lopputuloksen ennustamisessa. Tutkimuksessa, jonka tarkoituksena oli arvioida TA-pohjaisten koneoppimisalgoritmien diagnostista suorituskykyä PCNSL:n erottamisessa glioblastoomasta, esitettiin optimaalinen suorituskyky keskimääräisen AUC:n ollessa 0,921, kun taas kolmen lukijan AUC oli kaikilla <0,8. Näin ollen tutkijat päättelivät, että TA-pohjaisten koneoppimisalgoritmien diagnostinen suorituskyky oli parempi kuin ihmislukijoiden (25). Myös muut tutkimukset, joilla oli samanlainen tarkoitus, osoittivat samankaltaisia tuloksia AUC-arvojen ollessa yli 0,85 (18, 26). Lisäksi tutkijat, jotka pyrkivät soveltamaan koneoppimista astrosytooman luokittelussa, raportoivat myös lupaavasta erottelukyvystä (27). Tutkimuksessamme luokittelumallit laadittiin LDA-algoritmeihin perustuen. LDA on tilastollinen luokittelija, joka yhdistää syötetyt parametrit diskriminoivaksi funktioksi ja luokittelee tapaukset eri ryhmiin (28). Tuloksemme osoittivat, että LDA-pohjainen malli edusti lupaavaa suorituskykyä tarkassa diagnoosissa glioblastooman ja ANA:n välillä.
Koneoppimisalgoritmien optimaalisten piirteiden hyväksyminen oli haastavaa, mutta se oli välttämätöntä suhteessa diagnostiseen suorituskykyyn. Aiemmat tutkimukset suorittavat ominaisuuksien valinnan vaihtelevilla menetelmillä: Mann-Whitneyn U-testi ROC:n AUC:n kanssa, Studentin t-testi rekursiivisella piirteiden poistamisella, satunnaismetsä ja entropiaan perustuva diskretisointi vastaavasti (18, 25, 29, 30). Näiden tutkimusten tulosten perusteella voisimme tehdä sen johtopäätöksen, että sopivalla valintamenetelmällä on keskeinen rooli luokittelijan suorituskyvyssä. Tutkimuksessamme eri matriiseista poimittiin suhteellisen suuri määrä parametreja, mikä lisäsi mahdollisuuksia optimaalisten ominaisuuksien valintaan mutta myös vaikeutti valintaa. Siksi arvioitiin kolmea ominaisuuksien valintamenetelmää (etäisyyskorrelaatio, LASSO ja GBDT) parhaan suorituskyvyn omaavan menetelmän valitsemiseksi. Tämän tutkimuksen tulokset osoittivat, että LASSO+LDA oli sopiva erottelumalli glioblastoomalle ANA:sta, sillä testiryhmän korkein AUC oli 0,997. LASSO ehdotettiin aikaisemmassa tutkimuksessa epälineaariseksi muuttujien valintamenetelmäksi neuroverkkoa varten, ja sen etuna oli yhteisen neliövirheiden summan minimointi. Se voisi tuottaa tulkinnanvaraisia malleja (samanlaisia kuin osajoukon valinta), kun se samanaikaisesti osoittaa harjuregression vakautta. Aikaisempi tutkimus osoitti, että se oli suorituskyvyltään parempi kuin muut nykyaikaiset muuttujien valintamenetelmät (31). Tuloksia on kuitenkin tulkittava varovasti siten, että eri koneoppimistekniikoiden vertailusta saatava lisäinformaatiovoitto on varsin rajallinen, varsinkin kun otetaan huomioon, että kaikki tutkittavat luokittelu-/ominaisuuksienvalintamenetelmät näyttävät toimivan varsin vertailukelpoisesti ja että AUC-arvojen vaihtelu johtuu ehkä osittain tilastollisesta ryhmästä. Tämän vuoksi tutkimustamme voidaan pitää vain hypoteesien muodostamisena tulevia, laajempia tutkimuksia varten.
Tutkimuksessamme oli joitakin rajoituksia. Ensinnäkin, koska kyseessä oli retrospektiivinen yhden keskuksen tutkimus, potilaiden valintaan liittyvä harha oli väistämätön. Toiseksi mukaan otettujen potilaiden määrä oli suhteellisen pieni, ja lisätutkimuksissa tarvittiin suurempi määrä potilaita tulosten validoimiseksi. Kolmanneksi ANA jaetaan nyt kolmeen luokkaan Maailman terveysjärjestön vuoden 2016 keskushermoston kasvainten luokituksen mukaan: IDH-mutantti, IDH-villiintynyt ja NOS (32). Koneoppimisen kykyä ANA:n alatyyppien erottamisessa vaadittiin tutkittavaksi tulevissa tutkimuksissa. Neljänneksi, tutkimuksessamme käytettyjä koneoppimismalleja ei varsinaisesti validoitu muissa tietokokonaisuuksissa. Emme ottaneet käyttöön muita laitosten tietokokonaisuuksia, koska tekstuuriominaisuudet voivat olla erilaisia, kun ne uutetaan eri skannereilla tai protokollilla otetuista kuvista. Tätä voidaan pitää kaksiteräisenä miekkana. Toisaalta saataisiin joukko kontrolloituja muuttujia, mutta toisaalta tuloksia ei voitaisi taata laajasti sovellettaviksi. Analyysiprotokolla ja kuvankäsittelymenetelmä olivat avoimen lähdekoodin paketteja, ja tulostemme validoimiseksi ja toistamiseksi tarvitaan tutkimusta, jossa on mukana suuri populaatio.
Johtopäätös
Tässä työssä poimimme kvantitatiivisia parametreja kontrastinvahvistetuista magneettiresonanssikuvista ja hyödynsimme kolmea ominaisuuksien valintamenetelmää valitaksemme kaikkein erottelevimmat parametrit. Sitten sovelsimme LDA-algoritmia valittujen parametrien analysointiin. Tutkimuksemme osoittaa, että tekstuuriominaisuuksilla on lupaava kyky erottaa glioblastooma ANA:sta. Monikeskustutkimukset, joissa on suurempi määrä potilaita, ovat perusteltuja tämän alustavan tuloksen vahvistamiseksi.
Tietojen saatavuus
Jakaamme mielellämme tietojamme kaikille päteville tutkijoille ilman aiheettomia varauksia. Ottakaa yhteyttä vastaavaan kirjoittajaan, jos he tarvitsevat jotakin.
Eettinen lausunto
Tutkimukset, joihin osallistui ihmisiä, tarkistettiin ja hyväksyttiin Sichuanin yliopiston eettisessä komiteassa. Kirjallisen tietoon perustuvan suostumuksen tähän tutkimukseen osallistumisesta antoi osallistujien laillinen huoltaja/läheinen sukulainen. Henkilö(i)ltä ja alaikäisten lailliselta huoltajalta/läheisiltä sukulaisilta saatiin kirjallinen tietoinen suostumus tähän artikkeliin sisältyvien mahdollisesti tunnistettavien kuvien tai tietojen julkaisemiseen.
Tekijöiden panos
ZT, CC, JX ja XM osallistuivat tutkimuksen ideointiin ja suunnitteluun. CC ja XO rekisteröivät vaatimukset täyttävät potilaat ja hankkivat kunkin potilaan sairauskertomukset ja MRI-kuvat. YF ja ZT tekivät tekstuurianalyysin. JW laati mallit ja suoritti muut tilastolliset analyysit. ZT kirjoitti käsikirjoituksen ensimmäisen luonnoksen. CC kirjoitti käsikirjoituksen osat. Kaikki kirjoittajat osallistuivat käsikirjoituksen tarkistamiseen, lukivat ja hyväksyivät toimitetun version.
Esintressiristiriitoja koskeva lausunto
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Lisäaineisto
Tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: HISTO, Histogrammipohjainen matriisi; GLCM, Harmaan tason yhteisesiintymismatriisi; GLRLM, Harmaan tason juoksupituusmatriisi; GLZLM, Harmaan tason vyöhykkeen pituusmatriisi; NGLDM, Naapuruston harmaan tason riippuvuusmatriisi; AUC, Vastaanottajan tunnuslukukäyrän alapuolella oleva pinta-ala (Area under the receiver operating characteristic curve); PCNSL, Primaarinen keskushermostolymfooma (Primary central nervous system lymphoma); MLP, Monikerroksinen havaintoketju (Multilayer perceptron); IDH, Isositraattien dehydrogenaasi.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer statistics in China, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Anaplastinen astrosytooma. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnoosi ja hoito; tuore kirjallisuuskatsaus. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Stereotaktisen säteilykirurgian, jota seuraa tavanomainen sädehoito karmustiinilla, satunnaistettu vertailu tavanomaiseen sädehoitoon karmustiinilla potilailla, joilla on glioblastoma multiforme: raportti Radiation Therapy Oncology Group 93-05 -protokollasta. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. TUTKIMUKSET JA TUTKIMUSTULOKSET. Burger PC, Heinz ER, Shibata T, Kleihues P. Topografinen anatomia ja CT-korrelaatiot hoitamattomassa glioblastoma multiformessa. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Fysioterapia. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide kemoterapia yksinään vs. sädehoito yksinään pahanlaatuisen astrosytooman hoidossa iäkkäillä: NOA-08 satunnaistettu, vaiheen 3 tutkimus. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Primääristen aivokasvainten arvioinnin edistysaskeleet. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme ja anaplastinen astrosytooma. Patologiset kriteerit ja ennustetekijät. Syöpä. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastooma ja muut pahanlaatuiset glioomat: kliininen katsaus. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiation of uterine leiomyosarcoma from atypical leiomyoma: diagnostic accuracy of qualitative MR imaging features and feasibility of texture analysis. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. PubMed Abstract | CrossRef Full Text | Google Scholar
. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. MRI:n tekstuurianalyysin diagnostinen suorituskyky aivogliooman luokittelussa. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Rintojen kontrastivahvisteisten MR-kuvien tekstuurianalyysi. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Rintarauhasanalyysi. Castellano G, Bonilha L, Li LM, Cendes F. Lääketieteellisten kuvien tekstuurianalyysi. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Assessment of tumor heterogeneity: an emerging imaging tool for clinical practice? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vertaisarviointi. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastooma ja primaarinen keskushermoston lymfooma: preoperatiivinen erottelu MRI-pohjaisen 3D-tekstuurianalyysin avulla. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Magnetresonanssikuvan piirteet tunnistavat glioblastooman fenotyyppisiä alatyyppejä, joilla on erilainen molekyylireittien toiminta. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: freeware for radiomic feature calculation in multimodality imaging to accelerate advances in the characterization of tumor heterogeneity. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Cancer Res. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multiparametrinen magneettikuvaus ja tekstuurianalyysi tilallisen histologisen heterogeenisuuden ja kasvaimen laajuuden visualisoimiseksi glioblastoomassa. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametrinen magneettikuvaus primaaristen aivokasvainten arvioinnissa radiomaattisten piirteiden avulla: mittari ohjattua sädehoidon suunnittelua varten. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. TUTKIMUSLAITOS. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. Kuvan dynaamisen alueen vaikutus aivojen valkoisen aineen tekstuuriluokitukseen. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Prognostic value of computed tomography texture features in non-small cell lung cancer treated with definitive concomitant chemoradiotherapy. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.0000000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primaarinen keskushermoston lymfooma ja epätyypillinen glioblastooma: erotus radiomiikan lähestymistapaa käyttäen. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Röntgenkuvaus. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametrinen magneettikuvaus korkea-asteisten glioomien ja aivometastaasien erottamiseksi. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. J. Neurorad. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. Tukivektorikoneisiin perustuva kuva-analyysijärjestelmä aivokasvainastrosytoomien automaattiseen asteen diagnosointiin kliinisessä rutiinissa. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Ks. esim. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM ja LDA: vertaileva analyysi EMG-tiedoista ihmisiltä, joilla on transradiaalinen amputaatio. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classifying glioblastoma multiforme follow-up progressive vs. responsive forms using multi-parametric MRI features. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Tavanomaisen magneettikuvauksen kolmiulotteiset rakennepiirteet parantavat lasten aivokasvainten diagnostista luokittelua. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Monikerroksisen perceptron-neuraaliverkon muuttujanvalintamenetelmän suunnittelu ja soveltaminen LASSO:n avulla. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
.




