3.3 : Particules subatomiques – électrons, protons et neutrons
Identifier et localiser les particules subatomiques
En 1897, le physicien britannique J. J. Thomson (1856-1940) a prouvé que les atomes n’étaient pas la forme la plus fondamentale de la matière. Ses expériences impliquaient l’utilisation de tubes cathodiques (CRT). Dans un environnement sous vide, ces appareils produisent des rayons invisibles qui partent d’une électrode négative (cathode) et continuent vers une électrode positive (anode). Dans ces expériences, Thomson a démontré que les rayons cathodiques pouvaient être déviés, ou courbés, par des champs magnétiques ou électriques, ce qui indique que les rayons cathodiques sont constitués de particules chargées. Plus important encore, en mesurant l’ampleur de la déviation des rayons cathodiques dans des champs magnétiques ou électriques de différentes intensités, Thomson a pu calculer le rapport masse/charge des particules. Comme les charges semblables se repoussent et que les charges opposées s’attirent, Thomson en a conclu que les particules avaient une charge négative nette ; ces particules sont maintenant appelées électrons. Plus pertinent pour le domaine de la chimie, Thomson a découvert que le rapport masse/charge des rayons cathodiques est indépendant de la nature des électrodes métalliques ou du gaz, ce qui suggère que les électrons sont des composants fondamentaux de tous les atomes.
Durant les années 1910, les expériences avec les rayons X ont conduit à cette conclusion utile : la magnitude de la charge positive dans le noyau de chaque atome d’un élément particulier est la même. En d’autres termes, tous les atomes d’un même élément ont le même nombre de protons. En outre, les différents éléments ont un nombre différent de protons dans leur noyau, de sorte que le nombre de protons dans le noyau d’un atome est caractéristique d’un élément particulier. Cette découverte était si importante pour notre compréhension des atomes que le nombre de protons dans le noyau d’un atome est appelé numéro atomique. Ces expériences ont été réalisées par Ernest Rutherford. Il est crédité d’avoir défini un emplacement central de l’atome qui a maintenant été nommé le noyau.
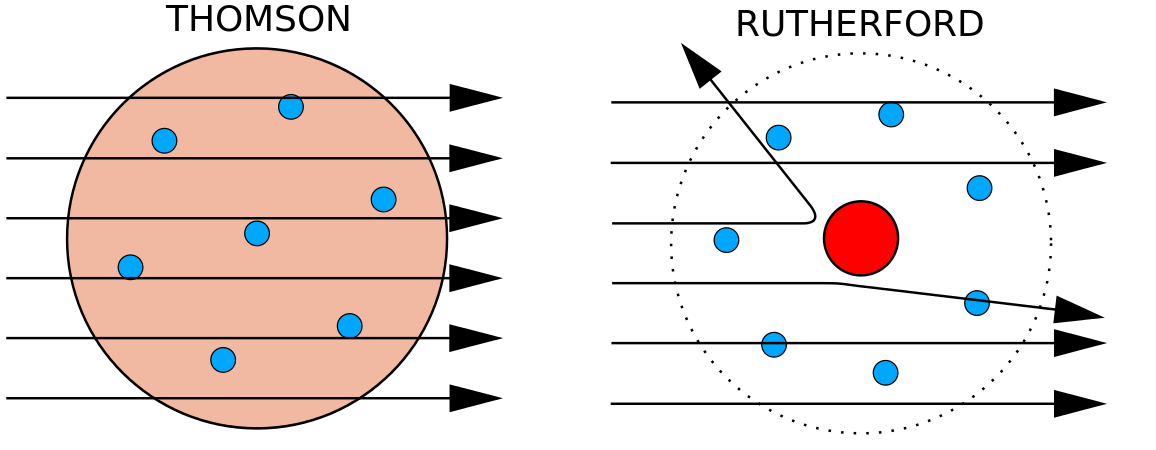
Rutherford était conscient que les protons se trouvaient à l’intérieur de cette région. L’un des collègues d’Ernest Rutherford, James Chadwick, a réalisé et étudié des réactions radioactives du béryllium. En frappant un noyau de béryllium avec des particules alpha, une particule de neutron était émise. En 1932, James Chadwick a annoncé l’existence d’une troisième particule subatomique, le neutron. Cette particule a une masse de 1 unité de masse atomique, mais ne possède pas de charge. Après cette découverte, la science et la technologie nucléaires ont commencé immédiatement.
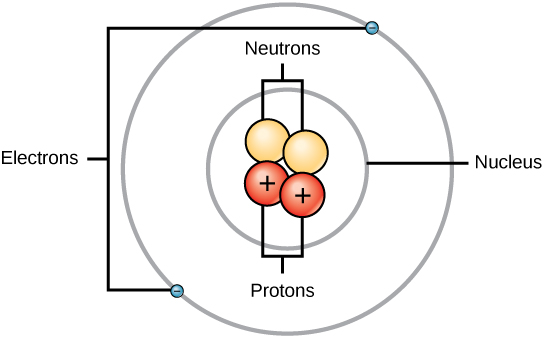
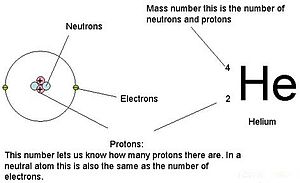
Les masses des trois particules subatomiques peuvent être exprimées en amu (unités de masse atomique) ou en grammes. Pour simplifier, nous utiliserons l’unité amu pour les trois subatomiques. Les neutrons et les protons ont chacun une masse de 1 amu. En revanche, l’électron a une masse négligeable de 0,0005 amu. La masse de ce subatomique n’est pas représentée dans la masse décimale qui figure sur le tableau périodique. Seuls les protons et les neutrons contribuent à la valeur de la masse d’un atome.
fr:User:Materialscientist)
Pour les atomes (espèces neutres), le nombre d’électrons est équivalent au nombre de protons. Par conséquent, tous les atomes ont une charge globale de zéro. Pour une discussion sur les ions (atomes qui gagnent ou perdent des électrons), reportez-vous à la dernière partie de ce chapitre. Les atomes dont les valeurs de neutrons et de masse diffèrent de celles du tableau sont appelés isotopes. Ces espèces particulières peuvent être vues dans la section suivante du texte.
| Particule subatomique | Symbole | Charge relative | Localisation | Masse amu |
|---|---|---|---|---|
| Proton | p | +1 | à l’intérieur du noyau | 1 |
| Neutron | n | 0 | à l’intérieur du noyau | 1 |
| Electron | e- | -1 | hors du noyau | 0.0005 (~0) |
Exemple \(\PageIndex{1}\)
Qu’est-ce qui est vrai ?
- Le noyau contient des protons et des électrons.
- La masse d’un électron est incluse dans la masse de l’atome
- Pour un atome, le nombre de protons = le nombre d’électrons.
Solution
- Faux, le noyau contient les protons et les neutrons. Les électrons sont à l’extérieur du noyau.
- Faux, les électrons ne contribuent pas au nombre de masse d’un atome.
- Vrai, tous les atomes sont neutres et doivent avoir le même nombre de protons que d’électrons.
.




