Chimie
La formation d’une solution est un exemple de processus spontané, c’est-à-dire un processus qui se produit dans des conditions spécifiées sans nécessiter d’énergie provenant d’une source extérieure. Parfois, nous remuons un mélange pour accélérer le processus de dissolution, mais cela n’est pas nécessaire ; une solution homogène se formerait si nous attendions suffisamment longtemps. Le sujet de la spontanéité est d’une importance capitale pour l’étude de la thermodynamique chimique et est traité plus en détail dans un chapitre ultérieur de ce texte. Pour les besoins de la discussion de ce chapitre, il suffira de considérer deux critères qui favorisent, mais ne garantissent pas, la formation spontanée d’une solution :
- une diminution de l’énergie interne du système (un changement exothermique, comme discuté dans le chapitre précédent sur la thermochimie)
- une augmentation du désordre dans le système (qui indique une augmentation de l’entropie du système, comme vous l’apprendrez dans le chapitre ultérieur sur la thermodynamique)
Dans le processus de dissolution, un changement d’énergie interne se produit souvent, mais pas toujours, car de la chaleur est absorbée ou dégagée. Une augmentation du désordre résulte toujours de la formation d’une solution.
Lorsque les forces des forces d’attraction intermoléculaires entre les espèces soluté et solvant dans une solution ne sont pas différentes de celles présentes dans les composants séparés, la solution se forme sans changement d’énergie qui l’accompagne. Une telle solution est appelée solution idéale. Un mélange de gaz idéaux (ou de gaz tels que l’hélium et l’argon, qui s’approchent de près du comportement idéal) est un exemple de solution idéale, puisque les entités composant ces gaz ne subissent aucune attraction intermoléculaire significative.
Lorsque des récipients d’hélium et d’argon sont connectés, les gaz se mélangent spontanément en raison de la diffusion et forment une solution (figure 2). La formation de cette solution implique clairement une augmentation du désordre, puisque les atomes d’hélium et d’argon occupent un volume deux fois plus grand que celui que chacun occupait avant le mélange.
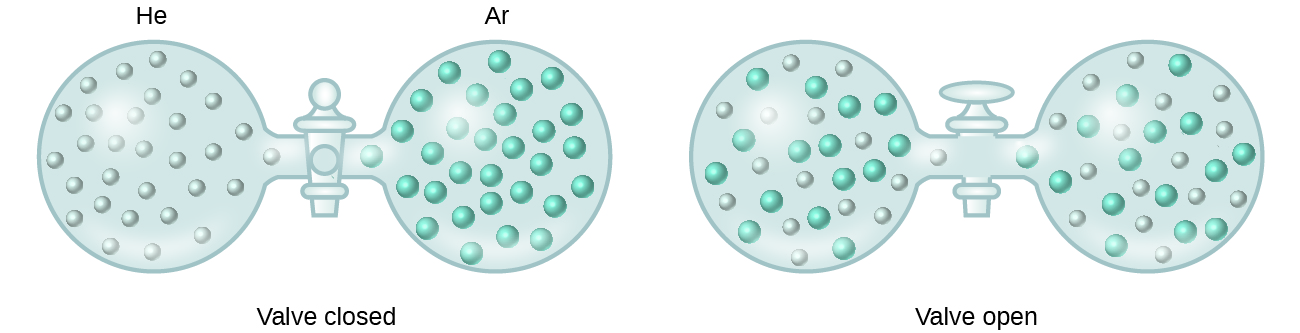
Des solutions idéales peuvent également se former lorsque des liquides structurellement similaires sont mélangés. Par exemple, les mélanges des alcools méthanol (CH3OH) et éthanol (C2H5OH) forment des solutions idéales, tout comme les mélanges des hydrocarbures pentane, C5H12, et hexane, C6H14. Si l’on place du méthanol et de l’éthanol, ou du pentane et de l’hexane, dans les ampoules illustrées à la figure 2, la diffusion et le mélange ultérieur de ces liquides seront identiques à ceux observés pour les gaz He et Ar (bien qu’à une vitesse beaucoup plus lente), ce qui donnera des solutions sans changement significatif de l’énergie. Contrairement à un mélange de gaz, cependant, les composants de ces solutions liquides-liquides subissent effectivement des forces d’attraction intermoléculaires. Mais comme les molécules des deux substances mélangées sont structurellement très similaires, les forces d’attraction intermoléculaires entre les molécules semblables et différentes sont essentiellement les mêmes, et le processus de dissolution n’entraîne donc pas d’augmentation ou de diminution sensible de l’énergie. Ces exemples illustrent comment la diffusion seule peut fournir la force motrice nécessaire pour provoquer la formation spontanée d’une solution. Dans certains cas, cependant, les amplitudes relatives des forces d’attraction intermoléculaires entre les espèces soluté et solvant peuvent empêcher la dissolution.
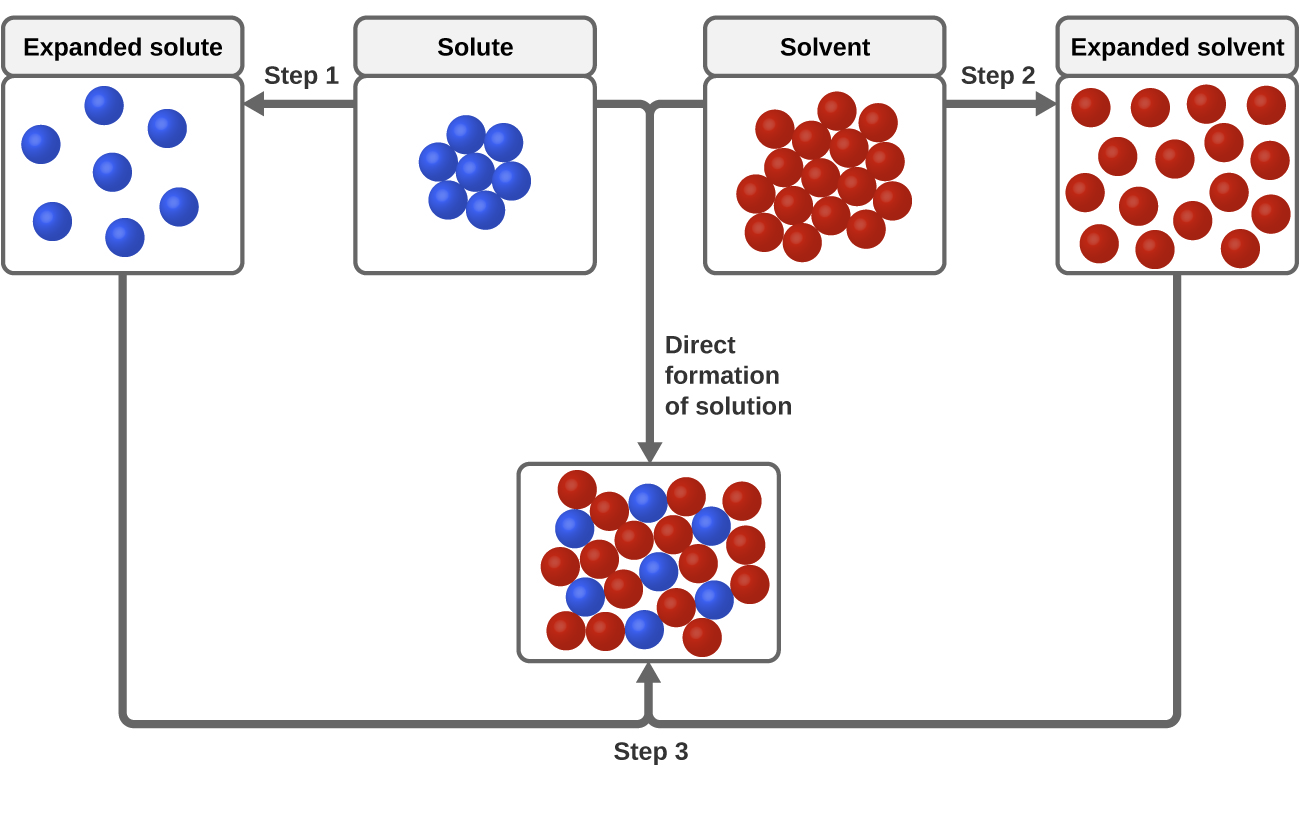
Trois types de forces d’attraction intermoléculaires sont pertinents pour le processus de dissolution : soluté-soluté, solvant-solvant et soluté-solvant. Comme l’illustre la figure 3, la formation d’une solution peut être considérée comme un processus par étapes dans lequel l’énergie est consommée pour surmonter les attractions soluté-soluté et solvant-solvant (processus endothermique) et libérée lorsque les attractions soluté-solvant sont établies (un processus exothermique appelé solvatation). Les amplitudes relatives des changements d’énergie associés à ces processus par étapes déterminent si le processus de dissolution dans son ensemble libère ou absorbe de l’énergie. Dans certains cas, les solutions ne se forment pas parce que l’énergie requise pour séparer les espèces soluté et solvant est tellement plus grande que l’énergie libérée par la solvatation.
Par exemple, les huiles de cuisson et l’eau ne se mélangent pas dans une mesure appréciable pour donner des solutions (figure 4). La liaison hydrogène est la force d’attraction intermoléculaire dominante présente dans l’eau liquide ; les molécules d’hydrocarbures non polaires des huiles de cuisson ne sont pas capables de liaison hydrogène, étant plutôt maintenues ensemble par des forces de dispersion. Pour former une solution huile-eau, il faudrait surmonter la liaison hydrogène très forte dans l’eau, ainsi que les forces de dispersion très fortes entre les molécules d’huile relativement grandes. Et, puisque les molécules d’eau polaires et les molécules d’huile non polaires ne subiraient pas une très forte attraction intermoléculaire, très peu d’énergie serait libérée par la solvatation.

En revanche, un mélange d’éthanol et d’eau se mélange dans n’importe quelles proportions pour donner une solution. Dans ce cas, les deux substances sont capables d’établir des liaisons hydrogène, et le processus de solvatation est donc suffisamment exothermique pour compenser les séparations endothermiques des molécules de soluté et de solvant.
Comme indiqué au début de ce module, la formation spontanée de solutions est favorisée, mais pas garantie, par les processus de dissolution exothermiques. Si de nombreux composés solubles se dissolvent, en effet, avec un dégagement de chaleur, certains se dissolvent de manière endothermique. Le nitrate d’ammonium (NH4NO3) est l’un de ces exemples et est utilisé pour fabriquer des poches de froid instantanées pour traiter les blessures, comme celle illustrée à la figure 5. Un sac en plastique à paroi mince contenant de l’eau est scellé dans un sac plus grand contenant du NH4NO3 solide. Lorsque le petit sac est brisé, une solution de NH4NO3 se forme, absorbant la chaleur de l’environnement (la zone blessée sur laquelle le sac est appliqué) et fournissant une compresse froide qui réduit le gonflement. Les dissolutions endothermiques telles que celle-ci nécessitent un apport d’énergie plus important pour séparer les espèces de solutés que celui récupéré lorsque les solutés sont solvatés, mais elles sont néanmoins spontanées en raison de l’augmentation du désordre qui accompagne la formation de la solution.


Voyez cette brève vidéo illustrant les processus de dissolution endothermique et exothermique.
Concepts clés et résumé
Une solution se forme lorsque deux ou plusieurs substances se combinent physiquement pour donner un mélange homogène au niveau moléculaire. Le solvant est le composant le plus concentré et détermine l’état physique de la solution. Les solutés sont les autres composants généralement présents à des concentrations inférieures à celle du solvant. Les solutions peuvent se former de manière endothermique ou exothermique, selon l’importance relative des forces d’attraction intermoléculaires du soluté et du solvant. Les solutions idéales se forment sans changement appréciable d’énergie.
Chimie Exercices de fin de chapitre
- Comment les solutions diffèrent-elles des composés ? D’autres mélanges ?
- Quelles sont les principales caractéristiques des solutions que l’on peut observer dans les solutions de K2Cr2O7 présentées dans la figure 1 ?
- Lorsque KNO3 est dissous dans l’eau, la solution obtenue est significativement plus froide que l’eau ne l’était à l’origine.
(a) La dissolution de KNO3 est-elle un processus endothermique ou exothermique ?
(b) Quelles conclusions pouvez-vous tirer sur les attractions intermoléculaires impliquées dans le processus ?
(c) La solution obtenue est-elle une solution idéale ?
- Donnez un exemple de chacun des types de solutions suivants :
(a) un gaz dans un liquide
(b) un gaz dans un gaz
(c) un solide dans un solide
- Indiquez les types d’attractions intermoléculaires les plus importants dans chacune des solutions suivantes :
(a) La solution de la figure 1.
(b) NO(l) dans CO(l)
(c) Cl2(g) dans Br2(l)
(d) HCl(aq) dans benzène C6H6(l)
(e) Méthanol CH3OH(l) dans H2O(l)
.
- Prédire si chacune des substances suivantes serait plus soluble dans l’eau (solvant polaire) ou dans un hydrocarbure tel que l’heptane (C7H16, solvant non polaire) :
(a) huile végétale (non polaire)
(b) alcool isopropylique (polaire)
(c) bromure de potassium (ionique)
- La chaleur est libérée lorsque certaines solutions se forment ; la chaleur est absorbée lorsque d’autres solutions se forment. Donnez une explication moléculaire de la différence entre ces deux types de processus spontanés.
- Des solutions d’hydrogène dans le palladium peuvent être formées en exposant le métal Pd à du gaz H2. La concentration d’hydrogène dans le palladium dépend de la pression de gaz H2 appliquée, mais d’une manière plus complexe que celle qui peut être décrite par la loi de Henry. Dans certaines conditions, 0,94 g de gaz hydrogène est dissous dans 215 g de palladium métallique.
(a) Déterminez la molarité de cette solution (densité de la solution = 1,8 g/cm3).
(b) Déterminer la molarité de cette solution (densité de la solution = 1,8 g/cm3).
(c) Déterminer le pourcentage en masse des atomes d’hydrogène dans cette solution (densité de la solution = 1,8 g/cm3).
.




