Chlorure de sodium, NaCl
Cas classique de liaison ionique, la molécule de chlorure de sodium se forme par l’ionisation des atomes de sodium et de chlore et l’attraction des ions résultants.
Un atome de sodium possède un électron 3s hors d’une coquille fermée, et il ne faut que 5,14 électron-volts d’énergie pour enlever cet électron. Le chlore manque d’un électron pour remplir une coquille, et libère 3,62 eV lorsqu’il acquiert cet électron (son affinité électronique est de 3,62 eV).Cela signifie qu’il ne faut que 1,52 eV d’énergie pour donner un des électrons du sodium au chlore lorsqu’ils sont éloignés. Lorsque les ions résultants sont rapprochés, leur énergie potentielle électrique devient de plus en plus négative, atteignant -1,52 eV à environ 0,94 nm de séparation. Cela signifie que si des atomes neutres de sodium et de chlore se trouvaient plus proches que 0,94 nm, il serait énergétiquement favorable de transférer un électron de Na à Cl et de former la liaison ionique.
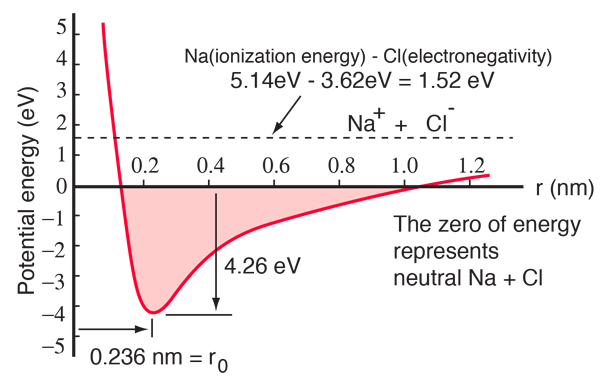
La courbe d’énergie potentielle montre qu’il y a un minimum à 0,236 nm de séparation, puis une forte augmentation du potentiel qui représente une force répulsive. Cette force répulsive est plus qu’une simple répulsion électrostatique entre les nuages d’électrons des deux atomes. Elle a un caractère de mécanique quantique ancré dans le principe d’exclusion de Pauli, et est souvent appelée simplement « répulsion du principe d’exclusion ». Lorsque les ions sont largement séparés, les fonctions d’onde de leurs électrons centraux ne se chevauchent pas de manière significative et ils peuvent avoir des nombres quantiques identiques. Lorsqu’ils se rapprochent, le chevauchement croissant des fonctions d’onde oblige certains d’entre eux à se placer dans des états d’énergie plus élevés. Deux électrons ne peuvent pas occuper le même état. Par conséquent, lorsqu’un nouvel ensemble d’états d’énergie est formé pour le système composite à deux noyaux, les états d’énergie inférieurs sont remplis et certains des électrons sont poussés vers des états plus élevés. Cela nécessite de l’énergie et est vécu comme une répulsion, empêchant les ions de se rapprocher les uns des autres.
Le diagramme de potentiel ci-dessus concerne le NaCl gazeux, et l’environnement est différent à l’état solide normal où le chlorure de sodium (sel de table commun) forme des cristaux cubiques. La séparation des ions est de 0,28 nm, un peu plus grande que celle de l’état gazeux.
Une partie importante de l’étude de la structure moléculaire est la description des liaisons chimiques qui se forment entre les atomes. Les études classiques sont les extrêmes de la liaison ionique dans le chlorure de sodium et de la liaison covalente dans la molécule d’hydrogène.
| Liens chimiques | Répulsion de Pauli dans les liaisons ioniques |
Exemple d’énergie de liaison




