Définition de la fonction d’onde
Les particules fondamentales, comme les électrons, peuvent être décrites comme des particules ou des ondes.
Les électrons peuvent être décrits en utilisant une fonction d’onde.Le symbole de la fonction d’onde est la lettre grecque psi, Ψ ou ψ.

La fonction d’onde Ψ est une expression mathématique.Elle porte des informations cruciales sur l’électron auquel elle est associée :à partir de la fonction d’onde, on obtient l’énergie, le moment angulaire et l’orientation orbitale de l’électron sous la forme des nombres quantiques n, l et ml.
La fonction d’onde peut avoir un signe positif ou négatif.Le signe est important dans les calculs.Il est également important lorsque les fonctions d’onde de deux ou plusieurs atomes se combinent pour former une molécule.
Les fonctions d’onde de signes semblables (ondes en phase) vont interférer de manière constructive, ce qui entraîne la possibilité d’une liaison.Les fonctions d’onde de signes non semblables (ondes déphasées) vont interférer de manière destructive.
En 1926, Erwin Schrödinger a déduit la fonction d’onde du plus simple de tous les atomes, l’hydrogène.La résolution de l’équation de Schrödinger permet aux scientifiques de déterminer les fonctions d’onde des électrons dans les atomes et les molécules.
L’équation de Schrödinger est une équation de la mécanique quantique : les fonctions d’onde calculées ont des valeurs discrètes et autorisées pour les électrons liés dans les atomes et les molécules ;toutes les autres valeurs sont interdites.
En plus de l’importance de Ψ, son carré Ψ2 a également une énorme signification en chimie.
Ψ2 est la densité de probabilité.Elle nous indique où l’électron a le plus de chances de se trouver dans l’espace autour du noyau.
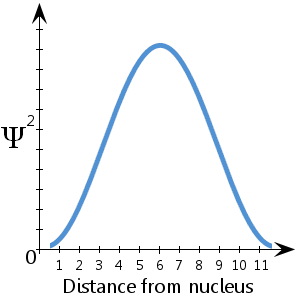
Par exemple, dans le diagramme schématique (fictif) tracé ici, montrant Ψ2 en fonction de la distance au noyau, on voit que l’électron a le plus de chances de se trouver entre 5 et 7 unités environ du noyau.On voit aussi qu’il y a une probabilité infime que l’électron se trouve au niveau du noyau ou à plus de 11½ unités environ du noyau.
Il y a une probabilité de 100 % que l’électron soit quelque part – autrement dit une probabilité de 1.
Ψ ne peut être calculée exactement que pour les atomes à un électron, c’est-à-dire H, He+, Li2+, Be3+, B4+, C5+, etc.En langage mathématique, on dit que les solutions analytiques de Ψ ne sont possibles que pour les systèmes à un électron.Les systèmes à un électron sont souvent décrits comme hydrogéniques – ce qui signifie « comme l’hydrogène ». »
Pour tous les autres atomes, ions et molécules, aucune solution analytique pour Ψ n’est possible;des méthodes d’approximation sont nécessaires pour le calculer.
Ψ2 et orbitales hydrogéniques
Placer la densité de probabilité de l’hydrogène (i.c’est-à-dire Ψ2) pour différents nombres quantiques nous permet de visualiser l’espace, centré sur le noyau, que les électrons occupent.Les différentes distributions de Ψ2 sont les orbitales électroniques de l’hydrogène.L’orbitale qui est effectivement occupée est déterminée par la quantité d’énergie de l’électron.
Exemples d’orbitales de l’hydrogène
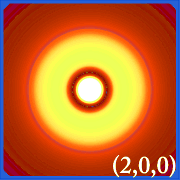
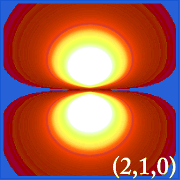

.




.




