Frontiers in Neuroscience
Introduction
La génération de nouveaux neurones dans l’hippocampe adulte, une région du cerveau impliquée dans la navigation spatiale et la formation de la mémoire (Buzsaki et Moser, 2013), est une forme frappante de plasticité qui persiste tout au long de la vie chez plusieurs espèces, y compris les humains (Altman et Das, 1965 ; Eriksson et al, 1998 ; Moreno-Jiménez et al., 2019). Parmi les nombreuses conditions régulant la neurogenèse hippocampique adulte, l’un des processus les plus fiables qui a été largement décrit est le déclin de la production neuronale médié par l’âge, alors que les populations neuronales préexistantes restent constantes avec le vieillissement normal (Kuhn et al., 1996 ; Kempermann et al., 1998 ; Burke et Barnes, 2010). Le vieillissement affecte de nombreuses fonctions du cerveau, notamment la transmission et la plasticité synaptiques, qui contribueraient à la perte de mémoire (Burke et Barnes, 2006 ; Fan et al., 2017). Étant donné que l’hippocampe est particulièrement vulnérable aux altérations liées à l’âge et à la neurodégénération, trouver des stratégies pour améliorer la plasticité dans cette structure devient pertinent pour prévenir ou atténuer les effets de la sénescence (Bartsch et Wulff, 2015). L’exercice physique et les stimuli cognitifs améliorent la santé du cerveau et tendent à atténuer les effets du vieillissement. L’un des avantages directs peut provenir de l’augmentation, liée à l’activité, des niveaux de facteur neurotrophique dérivé du cerveau (BDNF), dont il a été démontré qu’il restaure la plasticité synaptique, renforce la neurogenèse et améliore l’apprentissage chez les souris d’âge moyen (Marlatt et al., 2012 ; Trinchero et al., 2017). L’exercice réduit également l’activation de la microglie, augmente la plasticité synaptique dépendante de l’activité, la prolifération des cellules progénitrices neurales et accélère le développement et l’intégration des cellules granuleuses (CG) nées à l’âge adulte dans l’hippocampe vieillissant (van Praag et al., 2005 ; Kronenberg et al., 2006 ; O’Callaghan et al., 2009 ; Marlatt et al., 2012 ; Gebara et al., 2013). Ces effets contribuent à restaurer la plasticité dépendante de l’hippocampe et sont corrélés à un comportement adaptatif. Ainsi, les animaux âgés qui ont des performances médiocres dans les tâches d’apprentissage spatial et de séparation de formes, améliorent leurs performances après l’exercice (van Praag et al., 2005 ; Marlatt et al., 2012 ; Wu et al., 2015 ; Duzel et al., 2016 ; Xu et al., 2017).
La mesure dans laquelle la neurogenèse contribue aux effets comportementaux positifs de l’exercice chez les animaux vieillissants est encore examinée. Il est possible que l’augmentation du taux de neurogenèse exercée par l’exercice physique contribue à l’amélioration du comportement. Mais d’autres mécanismes peuvent également être impliqués (Meshi et al., 2006). L’intégration accélérée de nouveaux neurones dans le gyrus denté vieillissant après l’exercice, qui modifie la qualité des nouveaux GC, pourrait également contribuer à l’amélioration du comportement. Alors que les neurones nés chez des souris d’âge moyen se développent lentement, un exercice volontaire soutenu favorise la croissance dendritique, la formation d’épines et l’intégration neuronale (Trinchero et al., 2017). Des effets similaires ont été observés par de brèves expositions à l’enrichissement environnemental (EE) (Trinchero et al., 2019). Si elle est accumulée sur plusieurs cohortes neuronales, l’intégration neuronale accélérée déclenchée par l’exercice pourrait exercer une influence significative sur l’apprentissage et le comportement dépendant de l’hippocampe. Dans ce travail, nous démontrons que plusieurs cohortes de nouveaux GC peuvent être rapidement intégrées dans les circuits préexistants des souris qui continuent à s’engager dans la course volontaire, et que ces effets persistent une fois que les souris ont cessé de courir.
Matériel et méthodes
Souris et chirurgie
Les souris mâles C57BL/6J ont été logées à 4-5 animaux par cage dans des conditions standard. Les souris âgées de huit mois (8M) ont été sélectionnées car, au-delà de cet âge, il existe un fort déclin de la neurogenèse hippocampique qui empêche l’étude des neurones marqués (Morgenstern et al., 2008 ; Trinchero et al., 2017). Les souris ont été anesthésiées (150 μg de kétamine/15 μg de xylazine dans 10 μl de solution saline/g), et le rétrovirus a été infusé dans la région septale du gyrus denté droit (1,5 μl à 0,15 μl/min) à l’aide de pipettes microcapillaires calibrées stériles par chirurgie stéréotaxique ; coordonnées à partir du bregma (en mm) : -2 antéropostérieur, -1,5 latéral, et -1,9 ventral. Aux moments indiqués, les cerveaux ont été fixés et des sections ont été préparées pour l’imagerie confocale (Trinchero et al., 2017). Seuls les CG du gyrus denté septal ont été inclus dans l’analyse, correspondant aux sections localisées de -0,96 à -2,30 mm du bregma, selon l’atlas du cerveau de la souris (Paxinos et Franklin, 2001). Les protocoles expérimentaux ont été approuvés par le comité institutionnel de soins et d’utilisation des animaux de la Fundación Instituto Leloir, conformément aux principes de la recherche biomédicale impliquant des animaux du Conseil des organisations internationales des sciences médicales et aux dispositions énoncées dans le Guide pour le soin et l’utilisation des animaux de laboratoire.
Running
Les distances de course ont été enregistrées pour chaque expérience à l’aide de roues de course sans fil. Dans les expériences de la figure 1, les animaux ont été hébergés avec une roue de course pendant 7 ou 21 jours, comme indiqué. Dans ces conditions, les souris ont couru ∼2 km/jour. Dans les figures 2, 3 dans lesquelles les souris ont couru pendant 1, 2 ou 3 mois, la distance surveillée était de ∼10 km/jour.
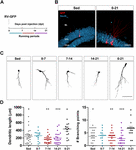
Figure 1. Des périodes de course longues mais pas courtes accélèrent la maturation morphologique des nouveaux GC. (A) Plan expérimental. L’injection de RV-GFP a été suivie d’une exposition à une semaine de course volontaire aux fenêtres indiquées ou pendant toute l’expérience (0-21 dpi). (B) Images représentatives des CG exprimant la GFP (rouge) à 21 dpi prises dans les groupes sédentaires et 0-21 course. Le NeuN (bleu) marque la couche des cellules granuleuses (GCL) (ML, couche moléculaire). Barre d’échelle, 50 μm. (C) Images confocales représentatives de GFP-GCs à 21 dpi pour les différents groupes. Barre d’échelle, 50 μm. (D) Complexité dendritique (longueur et points de branchement) pour les différentes fenêtres d’exécution. ∗, ∗∗, et ∗∗ dénotent p < 0,05, p < 0,01, et p < 0,001 par rapport au groupe de course 0-21 après test de Kruskal-Wallis suivi du test post hoc de Dunn. Aucune différence n’a été constatée entre les groupes courant pendant 7 jours. Taille des échantillons (neurones/souris) : 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) et 15/3 (0-21). Les barres horizontales indiquent la moyenne ± SEM. Les cercles ouverts correspondent à des exemples de neurones.
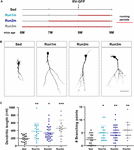
Figure 2. Effets de la course sur différentes cohortes neuronales. (A) Plan expérimental. L’injection de RV-GFP a été suivie de 3 semaines de course à pied et précédée par des conditions sédentaires (Run1m), 1 (Run2m), ou 2 mois de course à pied (Run3m). Tous les groupes ont été comparés à des souris sédentaires (Sed). La longueur dendritique totale a été analysée à 21 dpi. (B) Images confocales représentatives des GFP-GCs. Barre d’échelle, 50 μm. (C) Complexité dendritique (longueur et points de branchement) pour les différentes fenêtres de course. ∗, ∗∗, et ∗∗ dénotent p < 0,05, p < 0,01, et p < 0,001 par rapport à Sed après test de Kruskal-Wallis suivi du test post hoc de Dunn. Taille des échantillons (neurones/souris) : 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m), et 15/3 (Run3m). Les barres horizontales indiquent la moyenne ± SEM. Les cercles ouverts correspondent à des exemples de neurones.

Figure 3. Effets persistants de l’exercice chronique. (A) Plan expérimental. L’injection de RV-GFP a été suivie de 3 semaines de course (Run1m) ou précédée d’un mois d’exercice (Run-1m) ou d’un mois d’exercice et d’un mois sans roue de course (Run-2m). Tous les groupes ont été comparés à des souris sédentaires (Sed). La longueur dendritique totale a été analysée à 21 dpi. (B) Images confocales représentatives des GC marqués. Barre d’échelle, 50 μm. (C) Complexité dendritique (longueur et points de branchement) pour les différentes fenêtres de course. ∗∗∗ dénote p < 0,001 par rapport à Sed après test de Kruskal-Wallis suivi du test post hoc de Dunn. Taille des échantillons (neurones/souris) : 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) et 18/3 (Run-2m). (D) La morphologie des MFB dans CA3 a été analysée pour les groupes Run1m et Run-1m et comparée à Sed. Images confocales représentatives. Barre d’échelle, 5 μm. (E) ∗ et ∗∗ indiquent p < 0,05 et p < 0,01 après test de Kruskal-Wallis suivi du test post hoc de Dunn. Taille des échantillons : 27/4 (Sed), 32/4 (Run1m) et 18/4 (Run-1m). Les barres horizontales indiquent la moyenne ± SEM. Les cercles ouverts correspondent à des exemples de boutons.
Immunofluorescence
Les immunomarquages ont été réalisés sur des sections coronales flottantes libres de 60-μm. Les anticorps ont été appliqués dans une solution saline tris tamponnée (TBS) avec 3% de sérum d’âne et 0,25% de Triton X-100. L’immunofluorescence a été réalisée en utilisant des anticorps anti GFP (polyclonal de lapin ; 1:500 ; Invitrogen), anti NeuN (monoclonal de souris ; 1:50 ; un don de F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, États-Unis), des anticorps Cy3 anti-lapin d’âne et Cy5 anti-souris d’âne (1:250 ; Jackson Immuno Research Laboratories).
Microscopie confocale
Pour les mesures de la longueur dendritique, des images ont été acquises (40× ; NA 1,3 ; immersion dans l’huile) à partir de sections de 60-μm d’épaisseur en prenant des empilements en Z comprenant 35-50 tranches optiques, unité aérée = 1 à des intervalles de 0,8-μm (Trinchero et al, 2017). La longueur dendritique a ensuite été mesurée à l’aide du logiciel LSM Image Browser à partir des projections des reconstructions tridimensionnelles sur un seul plan dans les CG exprimant la GFP. Les images des MFB marquées par la GFP dans la région CA3 ont été acquises à des intervalles de 0,4μm (63× ; NA 1,4 ; immersion dans l’huile) et un zoom numérique de 6. La surface et le nombre de filopodes ont été analysés à partir de projections de reconstructions tridimensionnelles sur un seul plan. Les boutons de fibres moussues (MFB) qui répondaient aux critères suivants ont été sélectionnés pour la quantification : (i) le diamètre du bouton était >trois fois plus grand que le diamètre de la fibre, (ii) le bouton était connecté à la fibre moussue sur au moins une extrémité (Toni et al., 2008). Les filopodes ont été identifiés comme des protubérances provenant de grands terminaux moussus (1 μm < longueur < 20 μm) (Acsady et al., 1998). Les extensions filopodiales ont été mesurées en comptant le nombre de protubérances par terminal. Pour la capture d’images et l’analyse des propriétés morphologiques, tous les groupes expérimentaux étudiés étaient en aveugle de l’opérateur.
Analyse statistique
Sauf indication contraire, les données sont présentées sous forme de moyenne ± SEM. La normalité a été évaluée à l’aide du test de Shapiro-Wilks, du test omnibus de D’Agostino-Pearson et du test de Kolmogorov-Smirnov, avec une valeur p de 0,05. Lorsque les données répondaient aux tests de normalité (distribution gaussienne et variance égale), un test t non apparié avec correction de Welch ou une ANOVA avec test post hoc de Bonferroni ont été utilisés comme indiqué. Dans les cas où la normalité n’était pas respectée, des tests non paramétriques ont été utilisés comme suit : Test de Mann-Whitney pour les comparaisons indépendantes, et test de Kruskal-Wallis pour les comparaisons multiples.
Résultats
Nous avons précédemment montré que la course à pied accélère le développement et l’intégration fonctionnelle de nouveaux GC dans l’hippocampe vieillissant (Trinchero et al., 2017). Nous avons maintenant cherché à savoir si ce type de plasticité exige un niveau d’activité persistant qui s’accumule dans le temps, ou si des périodes de course plus courtes peuvent également déclencher une intégration plus rapide, comme cela a été précédemment observé pour l’exposition à l’EE (Trinchero et al., 2019). Pour répondre à cette question, de nouvelles cohortes neuronales ont été marquées chez des souris d’âge moyen (8 mois d’âge ; 8M) à l’aide d’un rétrovirus exprimant la GFP (RV-GFP). Les souris ont été autorisées à utiliser une roue de course pendant 1 semaine dans différentes fenêtres de développement neuronal, ou à courir pendant tout l’intervalle de croissance neuronale (3 semaines ; Figures 1A,B). Comme décrit précédemment, les nouveaux GC ont affiché un développement lent chez les souris sédentaires, ce qui s’est traduit par des dendrites courtes avec peu de ramifications à 3 semaines. Le fait de courir pendant une semaine n’a pas modifié l’aspect général des nouveaux GC dans aucun des intervalles testés (Figures 1C,D). En revanche, la course pendant tout l’intervalle de 3 semaines a entraîné une augmentation de la longueur et de la ramification des dendrites, ce qui est cohérent avec une intégration neuronale accélérée.
Les effets observés de l’exercice ont été testés sur une seule cohorte neuronale, celle qui a été marquée par voie rétrovirale. Cependant, comme de nouveaux GC sont continuellement générés, il est concevable que les GC nés à différents moments de la période d’exercice puissent également être influencés par l’activité. Pour tester cette hypothèse, nous avons utilisé une stratégie simple pour marquer des cohortes neuronales nées à différents moments par rapport au début de l’exercice en exposant les souris à des roues de course pendant différents intervalles, mais en analysant toujours la structure neuronale 3 semaines après l’injection rétrovirale (appelée 1m pour simplifier). Trois cohortes ont ainsi été comparées : l’une courant pendant 3 semaines, étiquetée dès le début de l’exercice (Run1m), l’autre courant pendant 2 mois, étiquetée 1 mois après le début de l’exercice (Run2m), et la dernière courant 3 mois, étiquetée 2 mois après le début de l’exercice (Run3m) (Figure 2A). Nous avons observé un degré similaire de croissance neuronale dans toutes les conditions par rapport aux souris sédentaires, ce qui indique que toutes les cohortes neuronales nées dans le cerveau d’une souris d’âge moyen effectuant une course volontaire subiront une croissance et une intégration rapides (Figures 2B,C). Les arbres dendritiques des GC des souris Run3m étaient légèrement plus longs que ceux des souris Run1m ou Run2m, ce qui suggère que la promotion de l’intégration neuronale pourrait répondre à un mécanisme dont l’effet s’accumule dans le temps. Pourtant, 1 mois de course a entraîné un effet quasi maximal sur le développement des GC.
Nous avons ensuite étudié les effets de l’exercice dans le cerveau vieillissant sur les cohortes neuronales nées une fois l’activité terminée. Nous avons comparé l’influence de la course à pied pendant 3-4 semaines sur le développement des nouveaux GC nés dès le début (Run1m), à la fin (Run-1m) ou 1 mois après la fin de l’exercice (Run-2m ; Figure 3A). De manière surprenante, les cohortes neuronales nées au début ou à la fin de la période de course ont répondu de manière similaire (Figures 3B,C). En revanche, les cohortes nées 1 mois après la fin de l’exercice (Run-2m) n’ont montré qu’un effet subtil.
Pour s’intégrer pleinement dans le circuit, les GC établissent des connexions excitatrices glutamatergiques sur les cellules pyramidales CA3 par l’intermédiaire de grandes MFB, et recrutent une inhibition feedforward GABAergique sur les cellules pyramidales via des extensions filopodales qui naissent de ces terminaux (Acsady et al, 1998 ; Toni et al., 2008 ; Sun et al., 2013 ; Restivo et al., 2015). Alors que l’analyse confocale n’a pas révélé de changements dans la surface des MFB des neurones nés à Run-1m ou Run1m par rapport aux contrôles, le nombre de filopodes/MFB a augmenté de ∼100% (Figures 3D,E). Ces résultats indiquent que l’exercice physique augmente spécifiquement la connectivité des nouveaux CG sur le réseau local inhibiteur (Trinchero et al., 2019).
Discussion
La neurogenèse adulte implique une séquence d’étapes développementales complexes qui aboutit à l’intégration de nouvelles unités de traitement de l’information. Les cellules souches neurales de la zone sous-granulaire quittent leur état quiescent pour devenir des cellules progénitrices neurales proliférantes qui étendent la population de précurseurs (cellules amplificatrices de transit) (Bonaguidi et al., 2012). Les cellules progénitrices génèrent des neurones qui migrent, se développent et s’intègrent dans le circuit. Pendant cette période prolongée, on observe une réduction marquée du pool neuronal en raison de la mort cellulaire apoptotique. L’exercice volontaire et l’EE constituent des stimuli puissants pour stimuler la neurogenèse hippocampique adulte chez les rongeurs tout au long de la vie (van Praag et al., 1999a, b ; Kronenberg et al., 2003, 2006 ; Wu et al., 2008 ; Kannangara et al., 2011). La neurogenèse diminue dans le cerveau vieillissant, principalement en raison de la réduction de la taille du pool de cellules progénitrices. La course à pied et l’EE peuvent toutes deux contrer la diminution de la production neuronale observée chez les animaux vieillissants, en agissant par le biais de mécanismes différents (Kempermann et al., 2010). La course à pied agit à deux niveaux pour améliorer la neurogenèse : elle augmente le taux de prolifération des cellules progénitrices neurales (van Praag et al., 1999b, 2005 ; Cooper et al., 2018) et accélère la maturation et l’intégration fonctionnelle des neurones en développement (Trinchero et al., 2017). L’EE augmente la survie et accélère également la maturation des nouveaux GC, mais elle n’influence pas la prolifération (Trinchero et al., 2017, 2019).
La course favorise également le recâblage de la connectivité neuronale et la modulation des propriétés intrinsèques dans les nouveaux GC au cours de la première semaine de développement chez les souris jeunes adultes (Sah et al., 2017). Nous avons récemment signalé une période critique au cours de la deuxième semaine de maturation des GCs chez les animaux vieillissants, au cours de laquelle l’EE induit une croissance dendritique et une intégration plus rapide des nouveaux neurones dans le circuit (Trinchero et al., 2019). Nous avons demandé ici si le fait de courir pendant 1 semaine à n’importe quel moment du développement des GCs affecterait leur intégration, mais nous n’avons trouvé aucun effet (Figure 1). La totalité de la période de course de 3 semaines était nécessaire pour réguler la neurogenèse. L’absence de modulation à court terme suggère un mécanisme médié par des facteurs qui doivent s’accumuler pour exercer des changements notables. Il est intéressant de noter que l’exercice volontaire exacerbe la production de BDNF, qui s’accumule pendant des semaines avant d’atteindre un niveau plateau qui exerce des actions maximales (Vecchio et al., 2018). Même si les neurotrophines sont des médiateurs clés, il est plausible que les effets observés ici soient médiés par de multiples mécanismes. L’exercice stimule également l’activité électrique dans le gyrus denté, augmente le flux sanguin et module la neuroinflammation (Piatti et al., 2011 ; Speisman et al., 2013 ; Trinchero et al., 2017). La contribution d’autres mécanismes nécessite des études supplémentaires.
Nous montrons ici que des GC âgés de ∼3 semaines provenant de souris vieillissantes exposées chroniquement à une roue de course (jusqu’à 3 mois) présentent un phénotype entièrement développé avec des arborisations dendritiques longues et complexes, similaires à celles des nouveaux GC générés chez les jeunes souris adultes (Figure 2). Les GC matures chez les souris jeunes adultes et d’âge moyen atteignent une longueur et une complexité dendritiques équivalentes à la fin du développement, comparables aux GC âgés de 3 semaines chez les souris vieillissantes exposées à l’EE ou à la course (Piatti et al., 2011 ; Trinchero et al., 2017, 2019). Ces preuves accumulées parlent d’une nette accélération de la vitesse de maturation évoquée par la course.
Au niveau de la sortie neuronale, la course a favorisé la croissance rapide des extensions filopodiales mais n’a pas modifié la taille des CG (Figures 3D,E). Ce résultat suggère que les nouvelles CG s’intègrent rapidement, mais que leur sortie pourrait être biaisée vers l’activation des interneurones GABAergiques dans CA3 (contactés par les filopodes), plutôt que vers les cellules pyramidales contactées par les MFB (Acsady et al., 1998 ; Toni et al., 2008 ; Sun et al., 2013 ; Restivo et al., 2015). Il est surprenant que l’EE provoque une augmentation marquée à la fois de la taille des MFB et du nombre d’extensions filopodales chez les souris vieillissantes, ce qui est cohérent avec une modulation plus équilibrée de la sortie neuronale (Trinchero et al., 2019). Nous supposons que les changements dus à l’EE impliquent un remodelage dépendant de l’activité de synapses spécifiques qui se renforcent pour encoder les indices spatiaux (Nicoll et Schmitz, 2005 ; Holtmaat et Svoboda, 2009). En revanche, la course peut représenter un stimulus général pour les nouveaux GC afin qu’ils se préparent à se connecter à des cibles spécifiques lorsque l’encodage devient nécessaire, tout en conservant le tonus inhibiteur des interneurones GABAergiques qui pourrait agir comme un mécanisme limitant l’activité postsynaptique jusqu’à ce que le nouveau GC ait été correctement assemblé au sein du réseau environnant.
Nos résultats indiquent que le cerveau vieillissant génère des signaux neurogéniques lorsque les souris continuent à courir pendant des périodes prolongées (mois). Dans ce contexte, les cohortes neuronales ultérieures nées chez les souris qui courent se développent et s’intègrent rapidement, permettant aux circuits vieillissants d’accumuler un nombre substantiel de nouveaux neurones (figure 4). L’incorporation continue de nouveaux GC dont les caractéristiques ressemblent à ce qui se passe chez les souris plus jeunes aboutit à un hippocampe rajeuni avec des neurones qui pourraient être amorcés pour répondre à des expériences futures.
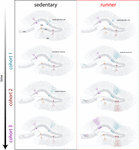
Figure 4. Rajeunissement induit par la course du réseau hippocampique chez les souris d’âge moyen. Représentation schématique de l’évolution temporelle de l’intégration neuronale chez les souris sédentaires (à gauche) et en course (à droite) après des intervalles prolongés d’exercice volontaire. Dans la zone subgranulaire du gyrus denté, les cellules de la glie radiale (RGL) restent dans un état quiescent (en haut). Les souris sédentaires vieillissantes présentent de faibles taux de neurogenèse et les nouveaux neurones se développent de manière lente (les cohortes représentatives sont indiquées par des couleurs différentes). Chez les souris qui courent, la production de nouveaux GC est stimulée, et ces nouvelles unités se développent et s’intègrent plus rapidement, étendant le réseau neuronal de manière cumulative sur une longue période. En fin de compte, ces nouvelles cohortes de neurones pleinement matures s’engagent à traiter les informations à la demande.
D’un point de vue plus large, l’augmentation de la longévité associée à la société moderne s’accompagne d’un risque plus élevé de déclin cognitif. Ainsi, il devient pertinent de comprendre les mécanismes sous-jacents aux bénéfices bien connus de l’exercice sur les fonctions cérébrales. En outre, il pourrait y avoir des différences à long terme entre les individus pratiquant l’exercice à différents intervalles de la vie et ceux qui l’ont pratiqué de manière continue, en termes de diminution du risque de développer des maladies neurodégénératives (Llorens-Martin, 2018). Nos résultats démontrent que la course continue favorise l’intégration de nombreuses cohortes neuronales, élevant ainsi la complexité du réseau de manière remarquable. La conception de différentes stratégies pour augmenter l’efficacité de l’intégration de nouveaux neurones dans l’hippocampe pourrait servir de mécanisme de plasticité prometteur pour éventuellement améliorer le déclin cognitif survenant dans le cerveau vieillissant sain et malade. Enfin, la dissection des mécanismes qui sous-tendent les différents aspects de cette intégration et de ce développement neuronal accéléré nous apprendra beaucoup sur le potentiel de plasticité des réseaux neuronaux dans le cerveau vieillissant.
Data Availability
Les données qui soutiennent les résultats de cette étude sont disponibles auprès de l’auteur correspondant sur demande raisonnable.
Déclaration éthique
L’étude sur les animaux a été examinée et approuvée par le comité pour l’utilisation et le soin des animaux de laboratoire de l’Institut Leloir.
Contributions des auteurs
MT et MH ont réalisé les expériences et analysé les données. MT, MH et AS ont conçu les expériences et rédigé le manuscrit. AS a fourni un soutien financier.
Funding
Ce travail a été soutenu par l’Agence argentine pour la promotion de la science et de la technologie (Grant# PICT2015-3814), le National Institute of Neurological Disorders and Stroke, et le Fogarty International Center (Grant# R01NS103758) à AS, qui est investigateur dans le Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT a été soutenu par une bourse CONICET.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions les membres du laboratoire d’AS pour les discussions perspicaces.
Acsady, L., Kamondi, A., Sik, A., Freund, T., et Buzsaki, G. (1998). Les cellules GABAergiques sont les principales cibles postsynaptiques des fibres de mousses dans l’hippocampe du rat. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., et Das, G. D. (1965). Preuve autoradiographique et histologique de la neurogenèse hippocampique postnatale chez le rat. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., et Wulff, P. (2015). L’hippocampe dans le vieillissement et la maladie : de la plasticité à la vulnérabilité. Neuroscience 309, 1-16. doi : 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., et Song, H. (2012). Une hypothèse unificatrice sur les propriétés des cellules souches neurales de mammifères dans l’hippocampe adulte. Curr. Opin. Neurobiol. 22, 754-761. doi : 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., et Barnes, C. A. (2006). La plasticité neuronale dans le cerveau vieillissant. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., et Barnes, C. A. (2010). Synapses sénescentes et dynamique des circuits hippocampiques. Trends Neurosci. 33, 153-161. doi : 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., et Moser, E. I. (2013). Mémoire, navigation et rythme thêta dans le système hippocampique-entorhinal. Nat. Neurosci. 16, 130-138. doi : 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., et van Praag, H. (2018). En fuite pour la plasticité hippocampique. Cold Spring Harb. Perspect. Med. 8:a029736. doi : 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., et Sendtner, M. (2016). L’exercice physique à un âge avancé peut-il améliorer la mémoire et la fonction hippocampique ? Brain 139, 662-673. doi : 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenesis in the adult human hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., et Villeda, S. A. (2017). Mécanismes du vieillissement de l’hippocampe et le potentiel de rajeunissement. Annu. Rev. Neurosci. 40, 251-272. doi : 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., et Toni, N. (2013). La neurogenèse hippocampique adulte est inversement corrélée à la microglie dans des conditions de course volontaire et de vieillissement. Front. Neurosci. 7:145. doi : 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., et Svoboda, K. (2009). Plasticité synaptique structurelle dépendante de l’expérience dans le cerveau des mammifères. Nat. Rev. Neurosci. 10, 647-658. doi : 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). La course à pied réduit le stress et améliore la genèse cellulaire chez les souris âgées. Neurobiol. Aging 32, 2279-2286. doi : 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Why and how physical activity promotes experience-induced brain plasticity. Front. Neurosci. 4:189. doi : 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., et Gage, F. H. (1998). Neurogenèse induite par l’expérience dans le gyrus denté sénescent. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., et Kempermann, G. (2006). L’exercice physique prévient le déclin lié à l’âge de l’activité des cellules précurseurs dans le gyrus denté de la souris. Neurobiol. Aging 27, 1505-1513. doi : 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Les sous-populations de cellules proliférantes de l’hippocampe adulte répondent différemment aux stimuli neurogènes physiologiques. J. Comp. Neurol. 467, 455-463. doi : 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., et Gage, F. H. (1996). Neurogenèse dans le gyrus denté du rat adulte : diminution liée à l’âge de la prolifération des progéniteurs neuronaux. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Exercer de nouveaux neurones pour vaincre la maladie d’Alzheimer. Brain Plast. 4, 111-126. doi : 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., et van Praag, H. (2012). La course à pied tout au long de l’âge moyen améliore la fonction de mémoire, la neurogenèse hippocampique et les niveaux de BDNF chez les souris C57BL/6J femelles. Dev. Neurobiol. 72, 943-952. doi : 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). La neurogenèse hippocampique n’est pas nécessaire pour les effets comportementaux de l’enrichissement environnemental. Nat. Neurosci. 9, 729-731. doi : 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). La neurogenèse hippocampique adulte est abondante chez les sujets neurologiquement sains et chute brutalement chez les patients atteints de la maladie d’Alzheimer. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., et Schinder, A. F. (2008). Les cellules granuleuses nouveau-nées dans le gyrus denté vieillissant. J. Physiol. 586, 3751-3757. doi : 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., et Schmitz, D. (2005). Plasticité synaptique aux synapses de la fibre moussue de l’hippocampe. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., et Kelly, A. M. (2009). L’exposition à long terme au tapis roulant protège contre les changements neurodégénératifs liés à l’âge dans l’hippocampe du rat. Hippocampus 19, 1019-1029. doi : 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., et Franklin, K. B. J. (2001). Le cerveau de la souris en coordonnées stéréotaxiques. Amsterdam : Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., et Schinder, A. F. (2011). Le moment de la maturation neuronale dans l’hippocampe adulte est modulé par l’activité du réseau local. J. Neurosci. 31, 7715-7728. doi : 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., et Frankland, P. W. (2015). Développement de la connectivité des cellules générées par les adultes avec les populations de cellules excitatrices et inhibitrices dans l’hippocampe. J. Neurosci. 35, 10600-10612. doi : 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., et van Praag, H. (2017). La course réorganise le circuit des neurones hippocampiques nés adultes d’une semaine. Sci. Rep. 7:10903. doi : 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., et Ormerod, B. K. (2013). L’exercice quotidien améliore la mémoire, stimule la neurogenèse hippocampique et module les cytokines immunitaires et neuro-immunes chez les rats vieillissants. Brain Behav. Immun. 28, 25-43. doi : 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). La reconstruction sans faille de neurones intacts nés chez l’adulte par imagerie end-block en série révèle un guidage et un développement axonaux complexes dans l’hippocampe adulte. J. Neurosci. 33, 11400-11411. doi : 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Les neurones nés dans le gyrus denté adulte forment des synapses fonctionnelles avec des cellules cibles. Nat. Neurosci. 11, 901-907. doi : 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Grande plasticité des nouvelles cellules granuleuses dans l’hippocampe vieillissant. Cell Rep. 21, 1129-1139. doi : 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., et Schinder, A. F. (2019). Plasticité structurelle dépendante de l’expérience des neurones nés adultes dans l’hippocampe vieillissant. Front. Neurosci. 13:739. doi : 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., et Gage, F. H. (1999a). La course améliore la neurogenèse, l’apprentissage et la potentialisation à long terme chez les souris. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). La course à pied augmente la prolifération cellulaire et la neurogenèse dans le gyrus denté de la souris adulte. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., et Gage, F. H. (2005). L’exercice améliore l’apprentissage et la neurogenèse hippocampique chez les souris âgées. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., et Aubert, I. (2018). Les effets neuroprotecteurs de l’exercice : maintenir un cerveau sain tout au long du vieillissement. Brain Plast. 4, 17-52. doi : 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). L’exercice améliore la prolifération des cellules souches neurales, la croissance des neurites et la survie des cellules progénitrices neuronales dans le gyrus denté des souris d’âge moyen. J. Appl. Physiol. 105, 1585-1594. doi : 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., et Hen, R. (2015). La course à pied sauve un déficit de discrimination contextuelle basé sur la peur chez les souris âgées. Front. Syst. Neurosci. 9:114. doi : 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). L’amélioration de la mémoire induite par la course à pied est corrélée à la préservation des épines fines dans l’aire hippocampique CA1 des vieilles souris C57BL/6. Neurobiol. Aging 52, 106-116. doi : 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.




