Frontiers in Oncology
Introduction
Le glioblastome et l’astrocytome anaplasique (AAN) sont deux des tumeurs cérébrales primaires les plus fréquentes chez l’adulte (1). On observe une véritable augmentation des taux d’incidence, notamment chez les personnes âgées (1-3). En pratique clinique, il est difficile de différencier les patients atteints de glioblastome de ceux atteints d’ANA avant la chirurgie ou la biopsie, car les symptômes et les signes des deux tumeurs sont relativement uniformes et non spécifiques (4, 5). Cependant, leur prise en charge est différente, notamment en ce qui concerne le protocole de chimiothérapie, le dosage et le mode d’administration (6). Par exemple, pour les patients atteints d’ANA (grade III de l’OMS), il est recommandé de recevoir une radiothérapie ou du TMZ après résection ou biopsie ; tandis que pour les patients nouvellement diagnostiqués avec un glioblastome (grade IV de l’OMS), il s’agit d’une radiothérapie plus du TMZ concomitant, suivi du TMZ adjuvant. Selon des études antérieures, le glioblastome et l’ANA se développent par invasion du tissu cérébral normal, se répandent dans le liquide céphalo-rachidien (LCR) et s’étendent au-delà de la distribution d’une seule artère carotide ou vertébrale. Ils répondent donc mal à la prise en charge médicale et deviennent les principales causes de décès par cancer chez les adultes (7, 8). En outre, le pronostic du glioblastome et de l’ANA sont différents. Dans la population âgée, il n’y a pas de différence significative dans le pronostic entre le glioblastome et l’ANA, mais la différence peut exister dans la population plus jeune (9). Par conséquent, il est difficile mais crucial de distinguer le glioblastome de l’ANA.
L’imagerie par résonance magnétique (IRM) est la neuroimagerie optimale dans le diagnostic préopératoire du glioblastome et de l’ANA pour sa capacité multiplanaire et son contraste supérieur des tissus mous. Bien que certaines études aient démontré que la présence d’un rehaussement annulaire et d’une nécrose était évocatrice d’un glioblastome, dans la plupart des cas, le glioblastome et l’ANA apparaissent comme des formes irrégulières sur les images RM (hyperdenses sur la séquence pondérée en T2 et hypodenses sur la séquence pondérée en T1) avec divers degrés de rehaussement de contraste à base de Gd et d’œdème, dont les différences étaient généralement imperceptibles à l’œil humain (10-12).
Récemment, l’analyse de texture (TA), également connue sous le nom de radiomique, a été largement appliquée dans différents domaines. Les chercheurs ont constaté que la TA était une méthode réalisable et prometteuse pour faciliter le diagnostic différentiel, car elle permettait d’acquérir des informations quantitatives supplémentaires à partir d’images RM qui étaient invisibles à l’évaluation humaine (13-15). L’AT décrit la distribution des fréquences et l’organisation spatiale de la valeur des voxels pour révéler les différences possibles dans le tissu tumoral (16). Des études antérieures ont exploré la possibilité d’appliquer l’AT au diagnostic différentiel, à la classification des sous-types de tumeurs et à la détection de l’hétérogénéité des tissus tumoraux (17-19). A notre connaissance, l’application de l’AT dans le diagnostic différentiel entre glioblastome et ANA n’a pas encore été rapportée. Le but de cette étude était d’évaluer la capacité discriminante de l’analyse de la texture de l’IRM en utilisant des algorithmes d’apprentissage automatique pour différencier le glioblastome et l’ANA.
Matériels et méthodes
Sélection des patients
Nous avons effectué une recherche rétrospective dans la base de données de notre institution et avons examiné tous les patients diagnostiqués histopathologiquement comme glioblastome ou ANA, de janvier 2015 à décembre 2018. Les critères d’éligibilité des patients qualifiés étaient : (1) diagnostic histopathologique concluant de glioblastome ou d’ANA ; (2) dossiers médicaux électroniques élaborés, en particulier le matériel pathologique ; (3) scanner MR diagnostique dans notre institution avant la résection chirurgicale. Les critères d’exclusion étaient : (1) antécédents de maladie intracrânienne (par exemple, traumatisme cérébral, infection intracrânienne ou autres types de tumeur cérébrale), compte tenu de l’interférence du tissu cicatriciel sur l’intensité des images ; (2) présence d’artefact de mouvement sur l’IRM ; (3) antécédents de traitements avant l’IRM (par exemple, chirurgie, chimiothérapie ou radiothérapie) ; (4) patients qui n’atteignaient pas les critères de diagnostic du glioblastome ou de l’ANA selon le système de classification de l’OMS de 2016. Un neuropathologiste senior ayant 10 ans d’expérience a jugé si le patient répondait aux critères (le système de classification de l’OMS 2016) de glioblastome ou d’ANA. Le conseil d’examen institutionnel a approuvé cette étude rétrospective. Le consentement éclairé écrit a été obtenu des participants inscrits à cette étude. Le comité d’éthique de l’Université du Sichuan et le service de radiologie de notre établissement ont approuvé l’utilisation des statistiques pour cette étude.
Acquisition d’images RM
Pour tous les patients inclus dans cette étude, des séquences pondérées en T1 renforcées par contraste étaient disponibles et ont été obtenues sur le scanner Siemens Trio 3.0T avec les paramètres suivants : TR/TE/TI = 1900/2,26/900 ms, angle de bascule = 9 °, 20 coupes axiales d’une épaisseur de 5 mm, FOV axial = 25,6 × 25,6 cm2 et matrice de données = 256 × 256. L’imagerie pondérée en T1 avec contraste a utilisé le gadopentetate dimeglumine (0,1 mmol/Kg) comme agent de contraste pour l’image avec contraste, et les données multidirectionnelles de l’IRM avec contraste ont été recueillies pendant le temps d’intervalle continu de 90-250 s.
Extraction de texture
Dans notre étude, le paquet LifeX (http://www.lifexsoft.org) a été utilisé pour extraire les caractéristiques de texture. Les images post-contraste pondérées en T1 (T1C) ont été sélectionnées pour une analyse plus approfondie en raison de la représentation claire de l’emplacement et de la frontière de la tumeur (20). La région d’intérêt (ROI) a été dessinée manuellement, tranche par tranche, dans le plan axial le long des lésions sur les images renforcées par contraste pour obtenir les caractéristiques de texture. Deux neurochirurgiens expérimentés, en aveugle par rapport aux dossiers médicaux des patients et au diagnostic histopathologique, ont dessiné la région d’intérêt, puis un radiologue et un neurochirurgien expérimentés l’ont modifiée. Les désaccords ont été résolus en discutant et en consultant le radiologue principal et le neurochirurgien principal. Au total, 40 caractéristiques de texture ont été extraites des images IRM, notamment la valeur minimale, la valeur moyenne, la valeur maximale, la valeur standard et les paramètres dérivés de six matrices : Matrice basée sur les histogrammes (HISTO), Forme, Matrice de cooccurrence de niveau de gris (GLCM), Matrice de longueur de course de niveau de gris (GLRLM), Matrice de longueur de zone de niveau de gris (GLZLM) et Matrice de dépendance de niveau de gris de voisinage (NGLDM).
Sélection des caractéristiques
Il y avait 40 caractéristiques de texture au total dérivées de six matrices sélectionnées. L’explication des 40 caractéristiques de texture a été présentée dans le tableau supplémentaire 1. Les statistiques de ces caractéristiques de texture sont présentées dans le tableau supplémentaire 2. La sélection des caractéristiques a été effectuée pour déterminer les caractéristiques pertinentes et éviter ainsi les surajustements. En outre, l’algorithme d’apprentissage automatique appliqué dans cette étude ne pouvait pas prendre en compte les 40 caractéristiques de texture. Trois méthodes indépendantes de sélection des caractéristiques ont été utilisées pour sélectionner les caractéristiques de texture optimales, notamment la corrélation par la distance, le LASSO (least absolute shrinkage, and selection operator) et le GBDT (gradient correlation decision tree). Trois sous-ensembles de caractéristiques de texture ont ainsi été formés et ont constitué trois ensembles de données différents.
Classification
L’analyse discriminante linéaire (LDA) est une méthode de classification robuste pour séparer deux classes en recherchant la combinaison linéaire de prédicteurs qui maximise la séparation entre les groupes. Dans cette étude, trois modèles de classification ont été établis sur la base de l’algorithme LDA : Corrélation de distance + LDA, LASSO + LDA, et GBDT + LDA. Les ensembles de données ont été introduits dans l’algorithme LDA, respectivement et indépendamment. Chaque ensemble de données a été divisé de manière aléatoire en un groupe de formation et un groupe de validation dans un rapport de 4:1. Le modèle formé par le groupe de formation a ensuite été appliqué au groupe de validation indépendant pour évaluer ses performances. Pour évaluer la robustesse de l’algorithme LDA, la procédure a été répétée pendant 100 cycles avec une affectation différente, aléatoire et indépendante des cas. Une matrice de confusion a été déterminée en utilisant l’affectation réelle de l’histopathologie et les prédictions de l’algorithme LDA. La sensibilité standard, la spécificité, les zones sous la courbe caractéristique d’exploitation du récepteur (AUC) et la précision ont été calculées pour le groupe de formation et le groupe de validation afin de révéler la capacité de discrimination des modèles. La comparaison de trois modèles (corrélation de distance + LDA, LASSO + LDA et GBDT + LDA) a été effectuée pour déterminer le modèle discriminant optimal pour le glioblastome et les ANA. L’organigramme de la classification de l’IRM par les caractéristiques de texture est présenté dans la figure 1.
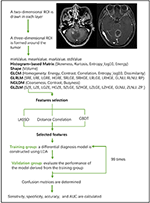
Figure 1. Organigramme de la classification de l’IRM par les caractéristiques de texture. ANA, astrocytome anaplasique ; LDA, analyse discriminante linéaire ; IRM, imagerie par résonance magnétique ; LASSO, opérateur de sélection et de rétrécissement le moins absolu ; GBDT, arbre de décision à corrélation de gradient ; HISTO, matrice basée sur l’histogramme ; GLCM, matrice de cooccurrence de niveau de gris ; GLRLM, matrice de longueur de course de niveau de gris ; GLZLM, matrice de longueur de zone de niveau de gris ; NGLDM, matrice de dépendance de niveau de gris de voisinage ; AUC, aire sous la courbe caractéristique d’exploitation du récepteur.
Résultats
Caractéristiques des patients
Un total de 133 patients atteints de glioblastome (n = 76) ou d’ANA (n = 57) ont rempli les critères d’inclusion. Tous les patients atteints de glioblastome ont été inclus dans cette étude, tandis que 10 patients atteints d’ANA ont été exclus selon les critères d’exclusion. Finalement, 76 patients atteints de glioblastome et 46 patients atteints d’ANA ont été inclus dans cette étude. L’âge moyen des patients était de 46,9 (15-67) et 40,0 (7-69), respectivement. Tous les patients ont subi une résection chirurgicale de la tumeur dans notre service de neurochirurgie de 2015 à 2018. La figure 2 montre deux cas du plan axial des images avec prise de contraste chez les patients atteints de glioblastome et d’ANA.
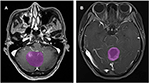
Figure 2. Exemples de deux cas tirés des images de résonance magnétique renforcées par contraste chez des patients atteints de glioblastome et d’ANA. (A) images avec prise de contraste avec ANA, (B) images avec prise de contraste avec glioblastome. ANA, astrocytome anaplasique.
Glioblastome vs. ANA
Trois modèles ont été analysés dans cette étude, notamment la corrélation de distance + LDA, LASSO + LDA, GBDT + LDA. Les caractéristiques de texture utilisées pour la classification dans ces modèles sont indiquées dans le tableau supplémentaire 3. Les performances de chaque modèle sont présentées dans le tableau 1 (y compris la sensibilité, la spécificité, la précision et l’AUC du groupe de formation et du groupe de validation). LASSO + LDA a obtenu les meilleures performances avec les AUC les plus élevées dans le groupe de formation et de validation. La sensibilité, la spécificité, la précision et l’AUC de son groupe de formation étaient respectivement de 0,989, 0,993, 0,996 et 0,997 ; et pour le groupe de validation, elles étaient respectivement de 0,927, 0,989, 0,968 et 0,974. En outre, la corrélation de distance + LDA et le GBDT + LDA ont également montré une capacité prometteuse à discriminer le glioblastome de l’ANA, avec une AUC ≥0,95 pour les groupes de formation et les groupes de validation.

Tableau 1. Discrimination entre glioblastome et ANA.
La figure 3 montre la relation entre les fonctions discriminantes canoniques issues des modèles LASSO + LDA pour les groupes glioblastome et ANA (triangles et cercles) et pour les centroïdes des groupes (carrés). Un chevauchement minimal a été observé dans cette figure. Qualitativement, l’analyse des données sélectionnées par LASSO a permis de séparer les glioblastomes des ANA. La figure 4 montre la distribution de la fonction LDA directe déterminée pour le glioblastome et l’ANA pour l’un des 100 cycles d’entraînement indépendants de l’analyse des données afin d’illustrer la performance du modèle LASSO + LDA. Il y avait des décalages clairs des valeurs de la fonction LDA, avec un décalage à gauche pour l’ANA et un décalage à droite pour le glioblastome.
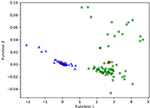
Figure 3. Relation entre les fonctions discriminantes canoniques issues des modèles LASSO + LDA pour les groupes glioblastome et ANA (triangles et cercles) et pour les centroïdes des groupes (carrés). Un chevauchement minimal a été observé dans cette figure. Qualitativement, l’analyse des données sélectionnées par LASSO a pu séparer les glioblastomes des ANA. LASSO, least absolute shrinkage and selection operator ; LDA, linear discriminant analysis ; ANA, Anaplastic astrocytoma.
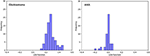
Figure 4. Distribution de la fonction LDA directe déterminée pour le glioblastome et l’ANA pour l’un des 100 cycles d’entraînement indépendants dans l’analyse des données pour illustrer la performance du modèle LASSO + LDA. Les valeurs de la fonction LDA sont clairement décalées, avec un décalage vers la gauche pour l’ANA et vers la droite pour le glioblastome. Le chevauchement minimal est observé entre les deux groupes et une forte similitude qualitative est apparente entre les tracés des cycles et des triangles. LDA, analyse discriminante linéaire ; ANA, astrocytome anaplasique ; LASSO, least absolute shrinkage and selection operator.
Discussion
Le diagnostic différentiel pré-traitement entre glioblastome et ANA est important compte tenu de la différence significative dans la stratégie de traitement et le pronostic des patients. L’IRM, principal examen radiologique préopératoire des tumeurs cérébrales, est fortement recommandée en raison de sa bonne sensibilité dans la détection des lésions. Cependant, le diagnostic précis avant l’opération reste un défi pour la raison que les deux tumeurs présentent des caractéristiques similaires sur les images RM conventionnelles qui sont au-delà de l’évaluation à l’œil nu de l’homme (4, 5). Dans cette étude, nous avons extrait des caractéristiques de texture permettant une description quantitative des images afin de maximiser l’utilisation de l’examen par RM, avec lesquelles trois modèles basés sur LDA ont été établis. Les résultats ont démontré que l’analyse de texture basée sur l’IRM combinée avec l’algorithme LDA pourrait permettre la différenciation faisable entre le glioblastome et l’ANA.
TA est une approche mathématique pour caractériser l’hétérogénéité de la valeur du voxel sur les images. Il pourrait visualiser l’hétérogénéité histologique spatiale qui est invisible à l’évaluation de l’œil humain (21). Théoriquement, les caractéristiques des images de lésions peuvent être analysées quantitativement comme des caractéristiques de texture en raison de leurs différents modèles améliorés sur les images RM (22). En outre, des études antérieures ont suggéré que les caractéristiques de textures pourraient refléter une série de processus pathologiques anormaux de la tumeur tels que l’œdème, l’effusion et la nécrose, fournissant un mécanisme potentiel pour les caractéristiques de texture dans la discrimination du glioblastome de l’ANA (23, 24).
L’intelligence artificielle a été largement explorée dans les recherches récentes. Combinée aux caractéristiques de texture extraites des images, elle a été rapportée pour aider à la classification des tumeurs, au diagnostic clinique et à la prédiction des résultats. Une étude visant à évaluer la performance diagnostique des algorithmes d’apprentissage automatique basés sur l’AT pour différencier le PCNSL du glioblastome a présenté une performance optimale avec l’AUC moyenne de 0,921, alors que les AUC de trois lecteurs étaient tous <0,8. Les chercheurs ont donc conclu que la performance diagnostique des algorithmes d’apprentissage automatique basés sur l’AT était supérieure à celle des lecteurs humains (25). D’autres études ayant un objectif similaire ont également démontré des résultats similaires avec des AUC supérieures à 0,85 (18, 26). De plus, des chercheurs visant à appliquer l’apprentissage automatique à la classification des astrocytomes ont également signalé une capacité de discrimination prometteuse (27). Dans notre étude, les modèles de classification ont été établis sur la base des algorithmes LDA. LDA est un classificateur statistique combinant des paramètres d’entrée dans une fonction discriminante pour classer les cas dans différents groupes (28). Nos résultats ont démontré que le modèle basé sur LDA représentait une performance prometteuse dans le diagnostic précis entre le glioblastome et l’ANA.
L’adoption sur les caractéristiques optimales pour les algorithmes d’apprentissage automatique était un défi mais était nécessaire par rapport à la performance du diagnostic. Les études précédentes effectuent la sélection des caractéristiques avec des méthodes variées : Test U de Mann-Whitney avec AUC de ROC, test t de Student avec élimination récursive des caractéristiques, forêt aléatoire et discrétisation basée sur l’entropie, respectivement (18, 25, 29, 30). Sur la base des résultats de ces études, nous avons pu tirer la conclusion que la méthode de sélection appropriée joue un rôle clé dans la performance du classificateur. Dans notre étude, un nombre relativement important de paramètres a été extrait de différentes matrices, ce qui augmente les chances de sélectionner les caractéristiques optimales mais aussi la difficulté de la sélection. Par conséquent, trois méthodes de sélection des caractéristiques (corrélation de distance, LASSO et GBDT) ont été évaluées afin de sélectionner celle qui présente les meilleures performances. Les résultats de cette étude ont démontré que LASSO+LDA était le modèle discriminant approprié pour le glioblastome par rapport à l’ANA avec l’AUC la plus élevée dans le groupe de test de 0,997. LASSO a été proposé comme méthode de sélection de variables non linéaires pour les réseaux neuronaux dans une étude précédente, avec l’avantage de minimiser la somme commune des erreurs au carré. Elle peut produire des modèles interprétables (similaires à la sélection de sous-ensembles) tout en présentant la stabilité de la régression ridge. Une étude précédente a montré qu’elle présentait des performances supérieures à celles d’autres méthodes de sélection de variables de pointe (31). Cependant, nous devons interpréter les résultats avec précaution, car le gain supplémentaire d’informations obtenu en comparant différentes techniques d’apprentissage automatique est assez limité, étant donné que toutes les méthodes de classification/sélection de caractéristiques étudiées semblent avoir des performances tout à fait comparables et que la variance de l’AUC peut être partiellement attribuée au groupe statistique. Par conséquent, notre étude ne peut être considérée que comme une génération d’hypothèses pour de futures études plus importantes.
Notre étude comportait certaines limites. Premièrement, en tant qu’étude rétrospective monocentrique, le biais de sélection des patients était inévitable. Deuxièmement, le nombre de patients inclus était relativement faible, et un plus grand nombre de patients était nécessaire dans les études ultérieures pour valider les résultats. Troisièmement, l’ANA est désormais divisé en trois catégories selon la classification 2016 de l’Organisation mondiale de la santé des tumeurs du système nerveux central : IDH-mutant, IDH-sauvage, et NOS (32). La capacité de l’apprentissage automatique à discriminer les sous-types d’ANA devait être explorée dans des études futures. Quatrièmement, les modèles d’apprentissage automatique de notre étude n’ont pas été réellement validés dans d’autres ensembles de données. Nous n’avons pas adopté les ensembles de données d’autres institutions parce que les caractéristiques de texture peuvent être différentes lorsqu’elles sont extraites d’images acquises avec différents scanners ou protocoles. Cela peut être considéré comme une arme à double tranchant. D’une part, on pouvait disposer d’un ensemble de variables contrôlées ; d’autre part, on ne pouvait pas garantir une application généralisée des résultats. Le protocole d’analyse et la procédure de traitement d’image étaient des paquets open-source et une étude avec une grande population est nécessaire pour valider et reproduire nos résultats.
Conclusion
Dans ce travail, nous avons extrait des paramètres quantitatifs à partir d’images RM renforcées par contraste et utilisé trois méthodes de sélection des caractéristiques pour sélectionner les paramètres les plus discriminants. Ensuite, nous avons appliqué l’algorithme LDA pour analyser les paramètres sélectionnés. Notre étude montre que les caractéristiques de texture ont une capacité prometteuse à discriminer les glioblastomes des ANA. Des études multicentriques avec un plus grand nombre de patients sont justifiées pour confirmer ce résultat préliminaire.
Data Availability
Nous sommes heureux de partager nos données à tout chercheur qualifié sans réserve excessive. Veuillez contacter l’auteur correspondant s’ils ont besoin de quelque chose.
Déclaration d’éthique
Les études impliquant des participants humains ont été examinées et approuvées par le comité d’éthique de l’Université du Sichuan. Le consentement éclairé écrit pour participer à cette étude a été fourni par le tuteur légal/le plus proche parent des participants. Le consentement éclairé écrit a été obtenu du ou des individus, et du tuteur légal/proche parent du ou des mineurs, pour la publication de toute image ou donnée potentiellement identifiable incluse dans cet article.
Contributions des auteurs
ZT, CC, JX et XM ont contribué à la conception et au design de l’étude. CC et XO ont recruté les patients éligibles et ont obtenu les dossiers médicaux et les images IRM de chaque patient. YF et ZT ont effectué l’analyse de la texture. JW a établi les modèles et effectué d’autres analyses statistiques. ZT a rédigé la première version du manuscrit. CC a rédigé des sections du manuscrit. Tous les auteurs ont contribué à la révision du manuscrit, ont lu et approuvé la version soumise.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abréviations
ANA, astrocytome anaplasique ; LDA, analyse discriminante linéaire ; IRM, imagerie par résonance magnétique ; MR, résonance magnétique ; LASSO, Least absolute shrinkage and selection operator ; GBDT, Gradient correlation decision tree ; LCR, liquide céphalorachidien ; TA, analyse de texture ; ROI, régions d’intérêt ; HISTO, matrice basée sur les histogrammes ; GLCM, matrice de cooccurrence de niveau de gris ; GLRLM, matrice de longueur de course de niveau de gris ; GLZLM, matrice de longueur de zone de niveau de gris ; NGLDM, matrice de dépendance de niveau de gris de voisinage ; AUC, aire sous la courbe caractéristique d’exploitation du récepteur ; PCNSL, lymphome primaire du système nerveux central ; MLP, perceptron multicouche ; IDH, isocitrate déshydrogénase.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Statistiques mondiales sur le cancer, 2012. CA Cancer J Clin. (2015) 65:87-108. doi : 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Statistiques sur le cancer en Chine, 2015. CA Cancer J Clin. (2016) 66:115-32. doi : 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Gliomes malins chez les adultes. N Engl J Med. (2008) 359:492-507. doi : 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Astrocytome anaplasique. CNS Oncol. (2016) 5:145-57. doi : 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnostic et traitement ; revue récente de la littérature. Curr Med Chem. (2017) 24:3002-9. doi : 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi : 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme : report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi : 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Topographic anatomy and CT correlations in the untreated glioblastoma multiforme. J Neurosurg. (1988) 68:698-704. doi : 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. La chimiothérapie au temozolomide seule contre la radiothérapie seule pour l’astrocytome malin chez les personnes âgées : l’essai randomisé de phase 3 NOA-08. Lancet Oncol. (2012) 13:707-15. doi : 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Progrès dans l’évaluation des tumeurs cérébrales primaires. Semin Nucl Med. (2008) 38:240-50. doi : 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastome multiforme et astrocytome anaplasique. Critères pathologiques et implications pronostiques. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastome et autres gliomes malins : une revue clinique. JAMA. (2013) 310:1842-50. doi : 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiation of uterine leiomyosarcoma from atypical leiomyoma : diagnostic accuracy of qualitative MR imaging features and feasibility of texture analysis. Eur Radiol. (2017) 27:2903-15. doi : 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol. (2016) 85:824-9. doi : 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Analyse de la texture des images RM renforcées par contraste du sein. Magn Reson Med. (2003) 50:92-8. doi : 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Texture analysis of medical images. Clin Radiol. (2004) 59:1061-9. doi : 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Assessment of tumor heterogeneity : an emerging imaging tool for clinical practice ? Insights Imaging. (2012) 3:573-89. doi : 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastome et lymphome primaire du système nerveux central : différenciation préopératoire en utilisant l’analyse de texture 3D basée sur l’IRM. Clin Neurol Neurosurg. (2018) 173:84-90. doi : 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Les caractéristiques des images de résonance magnétique identifient les sous-types phénotypiques de glioblastome avec des activités de voies moléculaires distinctes. Sci Transl Med. (2015) 7:303ra138. doi : 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx : un logiciel libre de calcul de caractéristiques radiomiques en imagerie multimodale pour accélérer les avancées dans la caractérisation de l’hétérogénéité tumorale. Cancer Res. (2018) 78:4786-9. doi : 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. IRM multiparamétrique et analyse de texture pour visualiser l’hétérogénéité histologique spatiale et l’étendue de la tumeur dans le glioblastome. PLoS ONE. (2015) 10:e0141506. doi : 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametric magnetic resonance imaging in the assessment of primary brain tumors through radiomic features : a metric for guided radiation treatment planning. Cureus. (2018) 10:e3426. doi : 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. L’impact de la gamme dynamique de l’image sur la classification de la texture de la matière blanche du cerveau. BMC Med Imaging. (2008) 8:18. doi : 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Valeur pronostique des caractéristiques de texture de la tomographie assistée par ordinateur dans les cancers pulmonaires non à petites cellules traités par chimioradiothérapie concomitante définitive. Invest Radiol. (2015) 50:719-25. doi : 10.1097/rli.0000000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Lymphome primaire du système nerveux central et glioblastome atypique : différenciation par une approche radiomique. Eur Radiol. (2018) 28:3832-9. doi : 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Imagerie par résonance magnétique multiparamétrique pour différencier les gliomes de haut grade et les métastases cérébrales. J Neuroradiol. (2012) 39:301-7. doi : 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. Un système d’analyse d’images basé sur des machines à vecteurs de support pour le diagnostic automatique de grade des astrocytomes de tumeurs cérébrales en routine clinique. Med Inform Internet Med. (2005) 30:179-93. doi : 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, and LDA : a comparative analysis on EMG data from people with trans-radial amputation. J Neuroeng Rehabil. (2017) 14:82. doi : 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classifying glioblastoma multiforme follow-up progressive vs. responsive forms using multi-parametric MRI features. Front Neurosci. (2016) 10:615. doi : 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Three-dimensional textural features of conventional MRI improve diagnostic classification of childhood brain tumours. NMR Biomed. (2015) 28:1174-84. doi : 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Conception et application d’une méthode de sélection de variables pour un réseau neuronal à perceptron multicouche avec LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi : 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. La classification 2016 de l’Organisation mondiale de la santé des tumeurs du système nerveux central : un résumé. Acta Neuropathol. (2016) 131:803-20. doi : 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
.




