Quelle est la différence entre les liaisons ioniques et covalentes
Chaque morceau de matière qui vous entoure est maintenu ensemble par des liaisons chimiques. Parfois, les liaisons chimiques sont rompues, comme lors d’une réaction chimique, pour que les atomes se lient à nouveau pour former des molécules différentes. De l’énergie est toujours libérée pour générer des liaisons et, de même, de l’énergie est toujours nécessaire pour rompre des liaisons.
Il existe deux principaux types de liaisons chimiques : ioniques et covalentes.
Qu’est-ce que les liaisons ioniques et covalentes ?
Les atomes se lient entre eux pour former des composés car, ce faisant, ils atteignent des énergies plus faibles que celles qu’ils possèdent en tant qu’atomes individuels, devenant ainsi plus stables. Selon la loi de la conservation de l’énergie, lorsqu’une nouvelle liaison chimique est formée, la réaction chimique libère une quantité d’énergie (généralement sous forme de chaleur) presque égale à la différence entre les quantités d’énergie chimique stockée entre les produits et les réactifs. Cette énergie chimique stockée du système, ou contenu thermique, est connue comme son enthalpie.
Une liaison ionique se forme lorsque deux ions de charges opposées échangent des électrons entre eux, où un ion est un atome qui a perdu ou gagné un électron. Les ions qui perdent un ou plusieurs électrons ont plus de protons que d’électrons, ce qui signifie qu’ils ont une charge positive. Ces ions sont appelés cations (métaux). En revanche, le fait de gagner des électrons confère à l’ion une charge négative. Les chimistes appellent de tels ions des anions (non-métaux).
Les composés ioniques sont généralement neutres. Par conséquent, les ions se combinent de manière à neutraliser leurs charges.
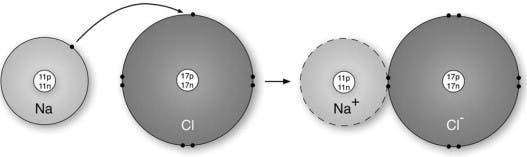
Un exemple classique de composé ionique est le chlorure de sodium, également connu sous le nom de sel de table. Un seul atome de sodium possède 11 protons et 11 électrons, mais un seul électron dans son enveloppe extérieure (ou enveloppe de valence). Le chlore est composé de 17 protons et 17 électrons, et possède 7 électrons dans sa coquille externe. Lorsque les deux atomes réagissent, le sodium (électropositif) perd son électron de valence au profit du chlore (électronégatif). Maintenant, dans la structure cristalline qui en résulte, chaque ion sodium est entouré de six ions chlorure et chaque ion chlorure est entouré de six ions sodium. De plus, chaque ion possède une enveloppe électronique complète qui correspond au gaz inerte le plus proche ; le néon pour un ion sodium, l’argon pour un ion chlorure
Les liaisons covalentes se forment lorsque des atomes ou des ions partagent des électrons de telle sorte que leurs enveloppes extérieures deviennent occupées. Les liaisons covalentes, également appelées liaisons moléculaires, ne se forment qu’entre des atomes non métalliques ayant une valeur d’électronégativité identique ou relativement proche. L’électronégativité, désignée par le symbole χ, est une propriété chimique qui décrit la tendance d’un atome à attirer vers lui une paire d’électrons partagée (ou densité électronique).
Le nombre de liaisons covalentes qu’un atome peut former est appelé la valence de l’atome. Cette propriété représente les électrons d’un atome qui peuvent participer à la formation de liaisons chimiques avec d’autres atomes. Ce sont les électrons les plus éloignés du noyau.
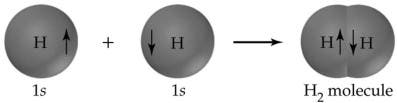
Un excellent exemple de liaison covalente est la molécule d’hydrogène, qui se forme à partir de deux atomes d’hydrogène, chacun ayant un électron dans sa couche externe. La formation d’une liaison libère de la chaleur ; elle est donc exothermique. Pour la molécule d’hydrogène, la chaleur libérée lors de sa formation, également appelée changement d’enthalpie standard (ΔH°), est de -435 kJ par mole. Le processus inverse, la rupture de la liaison H-H, nécessite 435 kJ par mole, une quantité appelée la force de la liaison.
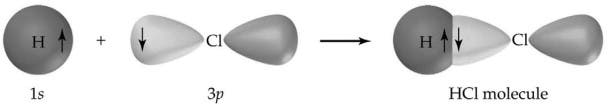
Un autre exemple classique de liaison covalente est le chlorure d’hydrogène (HCl), qui est un halogénure d’hydrogène. L’atome de chlore a 7 atomes dans sa coquille externe tandis que l’hydrogène a 1 électron dans sa coquille externe. Les deux se combinent parfaitement pour que chaque atome remplisse sa coquille de valence, formant ainsi une molécule très stable. Maintenant, la molécule de HCl ne réagira plus avec d’autres atomes de chlore ou d’hydrogène.
Différences entre les liaisons ioniques et covalentes
- Les liaisons covalentes sont beaucoup plus courantes en chimie organique que les liaisons ioniques.
- Dans les liaisons covalentes, les atomes partagent des électrons, alors que dans les liaisons ioniques, les atomes transfèrent des électrons.
- Les composants réactionnels des liaisons covalentes sont électriquement neutres, alors que pour les liaisons ioniques, ils sont tous deux chargés. Cela explique pourquoi le chlorure de sodium (sel) conduit l’électricité lorsqu’il est dissous – ses composants sont chargés.
- Les liaisons ioniques sont beaucoup plus fortes que les liaisons covalentes.
- Les liaisons covalentes sont beaucoup plus courantes dans la nature que les liaisons ioniques. La plupart des molécules des êtres vivants sont liées par des liaisons covalentes, par exemple.
- Les liaisons covalentes peuvent se former entre des atomes de mêmes éléments (c’est-à-dire H2). En revanche, les liaisons ioniques ne peuvent pas le faire.
- Les liaisons covalentes se forment entre deux non-métaux, alors que les liaisons ioniques se forment entre un métal et un non-métal.
- Les molécules formées par des liaisons covalentes ont un point de fusion bas, alors que celles avec des liaisons ioniques ont un point de fusion élevé. La même relation existe pour le point d’ébullition.
- À température ambiante, les molécules à liaisons covalentes sont dans la grande majorité des cas liquides ou gazeuses, alors que les composés ioniques sont solides.
Similitudes entre les liaisons ioniques et covalentes
- Les deux types de liaisons conduisent à la formation de composés chimiques stables.
- Il faut des réactions exothermiques (c’est-à-dire qui dégagent de la chaleur) pour créer des liaisons ioniques et covalentes.
- Les électrons de valence sont impliqués dans les deux processus de liaison.
- Il importe peu qu’une molécule soit formée par une liaison ionique ou covalente en ce qui concerne sa charge électrique : le résultat est toujours électriquement neutre.




