3.3: Subatomic Particles – Electrons, Protons, and Neutrons
Identifying and Locating the Subatomic Particles
1897-ben J. J. Thomson (1856-1940) brit fizikus bebizonyította, hogy az atomok nem az anyag legalapvetőbb formája. Kísérleteiben katódsugárcsöveket (CRT) használt. Ezek a készülékek vákuumozott környezetben láthatatlan sugarakat bocsátanak ki, amelyek egy negatív elektródából (katód) indulnak ki, és egy pozitív elektródhoz (anód) vezetnek tovább. Ezekben a kísérletekben Thomson kimutatta, hogy a katódsugarak mágneses vagy elektromos mezőkkel eltéríthetők vagy meghajlíthatók, ami azt jelezte, hogy a katódsugarak töltött részecskékből állnak. Ami még fontosabb, hogy a katódsugarak eltérítésének mértékét különböző erősségű mágneses vagy elektromos mezőkben mérve Thomson ki tudta számítani a részecskék tömeg-töltés arányát. Mivel a hasonló töltések taszítják egymást, az ellentétes töltések pedig vonzzák egymást, Thomson arra a következtetésre jutott, hogy a részecskék nettó negatív töltéssel rendelkeznek; ezeket a részecskéket ma elektronoknak nevezzük. A kémia szempontjából a legfontosabb, hogy Thomson megállapította, hogy a katódsugarak tömeg-töltés aránya független a fémelektródok vagy a gáz jellegétől, ami arra utalt, hogy az elektronok minden atom alapvető összetevői.
Az 1910-es években a röntgensugarakkal végzett kísérletek a következő hasznos következtetéshez vezettek: egy adott elem minden atomjának magjában a pozitív töltés nagysága azonos. Más szóval, ugyanannak az elemnek minden atomja ugyanannyi protonnal rendelkezik. Továbbá a különböző elemek atommagjában különböző számú proton van, így az atom atommagjában lévő protonok száma az adott elemre jellemző. Ez a felfedezés olyan fontos volt az atomok megértéséhez, hogy az atommagban lévő protonok számát atomszámnak nevezik. Ezeket a kísérleteket Ernest Rutherford végezte. Neki tulajdonítják, hogy meghatározta az atom központi helyét, amelyet ma magnak neveznek.
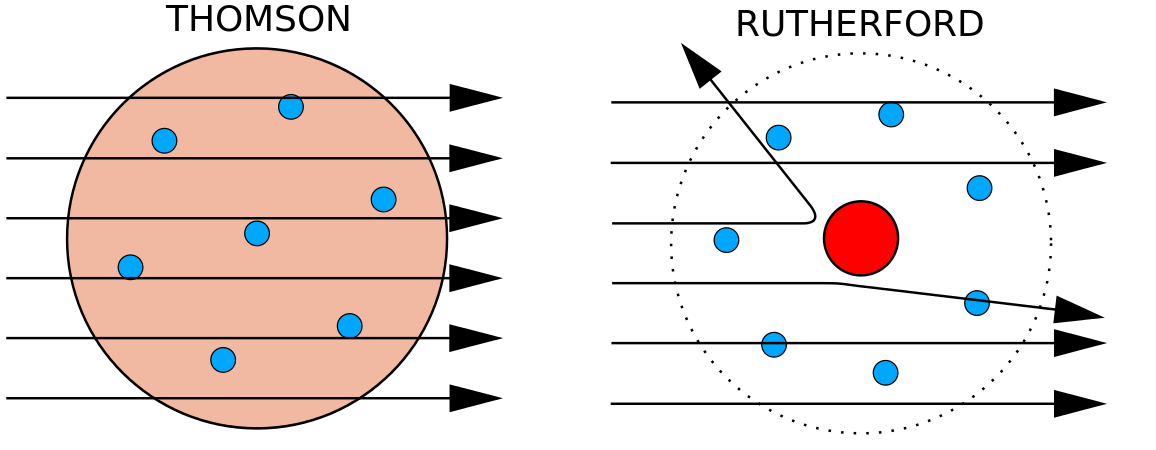
Rutherford tisztában volt azzal, hogy a protonok ezen a területen belül vannak. Ernest Rutherford egyik munkatársa, James Chadwick radioaktív reakciókat végzett és tanulmányozott berilliummal. A berillium atommagját alfa-részecskékkel eltalálva neutronrészecske szabadult fel. 1932-ben James Chadwick bejelentette egy harmadik szubatomi részecske, a neutron létezését. Ennek a részecskének a tömege 1 atomi tömegegység, de nincs töltése. E felfedezés után azonnal megindult a nukleáris tudomány és technológia.
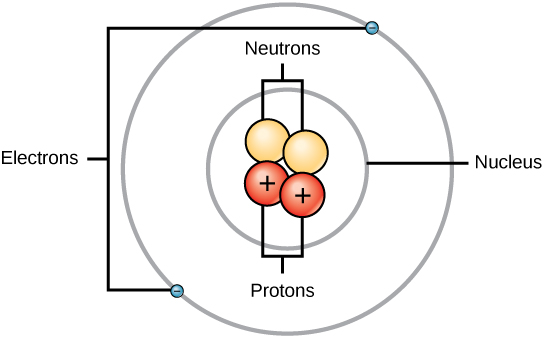
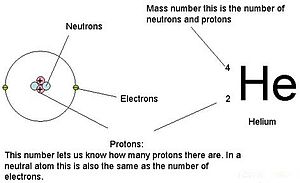
A három szubatomi részecske tömegét amu (atomi tömegegység) vagy grammban lehet kifejezni. Az egyszerűség kedvéért a három szubatomi részecske esetében az amu egységet használjuk. A neutronok és a protonok tömegét egyenként 1 amu tömegűnek határozzuk meg. Ezzel szemben az elektron tömege elhanyagolható, 0,0005 amu. Ennek a szubatomnak a tömege nem jelenik meg a periódusos rendszerben feltüntetett decimális tömegben. Csak a protonok és a neutronok járulnak hozzá az atom tömegének értékéhez.
en:User:Materialscientist)
Atomok (semleges fajok) esetében az elektronok száma megegyezik a protonok számával. Ennek következtében minden atom össztöltése nulla. Az ionok (olyan atomok, amelyek elektronokat nyernek vagy veszítenek) tárgyalása e fejezet második részében található. A táblázatban szereplő neutron- és tömegértékekben eltérő atomokat izotópoknak nevezzük. Ezeket a különleges fajokat a szöveg következő részében láthatjuk.
| Subatomi részecske | Szimbólum | Relatív töltés | Helyszín | Amu tömeg |
|---|---|---|---|---|
| Proton | p | +1 | az atommag belsejében | 1 |
| Neutron | n | 0 | az atommag belsejében | 1 |
| Elektron | e- | -1 | az atommagon kívül | 0.0005 (~0) |
Példa \(\PageIndex{1}\)
Melyik igaz?
- A mag protonokat és elektronokat tartalmaz.
- Az elektron tömege beleszámít az atom tömegébe
- Az atom esetében a protonok száma = az elektronok száma.
Megoldás
- Hamis, az atommag tartalmazza a protonokat és a neutronokat. Az elektronok a magon kívül vannak.
- Hamis, az elektronok nem járulnak hozzá az atom tömegszámához.
- Igaz, minden atom semleges, és ugyanannyi protonnal és elektronnal kell rendelkeznie.




