Enzimgátlás
Az élethez szükséges folyamatok többségéhez, ha nem is az összeshez, enzimek szükségesek. Az enzimek egy reakciót úgy katalizálnak, hogy csökkentik a reakció lejátszódásához szükséges aktiválási energiát. Az enzimeket azonban szigorúan szabályozni kell, hogy a termék szintje ne emelkedjen nemkívánatos szintre. Ezt az enzimgátlással érik el.
A gátlás típusai
A visszafordítható és irreverzibilis inhibitorok olyan vegyi anyagok, amelyek egy enzimhez kötődve elnyomják annak aktivitását. Ennek egyik módszere az, hogy szinte állandóan kötődnek egy enzimhez. Az ilyen típusú inhibitorokat irreverzibilisnek nevezzük. Más vegyi anyagok azonban átmenetileg is kötődhetnek egy enzimhez. Ezeket reverzibilisnek nevezik. A reverzibilis inhibitorok vagy az aktív helyhez (kompetitív inhibitorok), vagy az enzim egy másik helyéhez (nem kompetitív inhibitorok) kötődnek.
 1. ábra – A kompetitív és nem kompetitív enzimgátlók hatását bemutató ábra.
1. ábra – A kompetitív és nem kompetitív enzimgátlók hatását bemutató ábra.Kompetitív inhibitorok
A kompetitív inhibitorok az aktív helyen versenyeznek a szubsztráttal, és ezért növelik a Km (Michaelis-Menten állandó) értéket. A Vmax azonban nem változik, mert elegendő szubsztrátkoncentráció esetén a reakció még mindig befejeződhet. Az enzimaktivitás és a szubsztrátkoncentráció grafikonja a Km növekedése miatt jobbra tolódik, míg a Lineweaver-Burke-diagram meredekebb lesz, mintha nem lenne inhibitor.
Non-kompetitív inhibitorok
A nem-kompetitív inhibitorok az enzim egy másik helyéhez kötődnek, és így csökkentik a VMAX-ot. A KM azonban változatlan marad. Ezt mutatja, hogy az enzimaktivitást a szubsztrátkoncentrációval szemben ábrázoló grafikonon alacsonyabb a maximum, a Lineweaver-Burke-diagramon pedig magasabb az y-interceptus, ha összehasonlítjuk az inhibitor nélkülivel.
| kompetitív | nemkompetitív | |
| Hol hat? | Aktív telephely | Alternatív telephely |
| Km-változás | Növekedés | Változatlanul |
| Vmax változása | Változatlan | csökkenés |
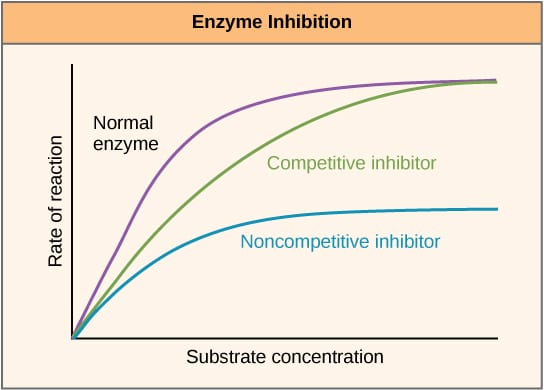 2. ábra. Az enzimgátlók reakciósebességre gyakorolt hatását és annak változását a szubsztrátkoncentráció függvényében bemutató ábra.
2. ábra. Az enzimgátlók reakciósebességre gyakorolt hatását és annak változását a szubsztrátkoncentráció függvényében bemutató ábra.Alloszterikus gátlás
Alloszterikus enzimek a Michaelis-Menten enzimek által mutatott hiperbolikus görbével ellentétben szigmoid görbét mutatnak. Ennek oka, hogy a legtöbb alloszterikus enzim több alegységet tartalmaz, amelyek hatással lehetnek egymásra, amikor a szubsztrát az enzimhez kötődik. A gátlás befolyásolhatja a K0,5 értéket, amely a szubsztrátkoncentrációt a féltelítettséghez, a Vmax értéket vagy mindkettőt. Ez a görbe jobbra tolódását eredményezi, a Vmax csökkenése esetén pedig lefelé tolja a görbét.
Az alloszterikus enzimeknek két állapota van: a “T” állapotnak nevezett alacsony affinitású állapot és a nagy affinitású “R” állapot. Az inhibitorok úgy hatnak, hogy előnyösen kötődnek az alloszterikus enzim T állapotához, és az enzimet ennek az alacsony affinitású állapotnak a fenntartására késztetik.
Ez rendkívül hasznos egy enzim termékének mennyiségének korlátozására, mivel a termék ezután tovább gátolhatja az azonos típusú enzimet, hogy a termék mennyisége ne legyen túlzott. Ezt nevezzük visszacsatolásos gátlásnak. Például az ATP alloszterikusan gátolja a piruvát-kinázt, hogy megakadályozza a piruvát fokozott képződését, így végül kevesebb ATP képződik. Ezenkívül a foszfofruktokinázt alloszterikusan gátolja a citrát, a Kreb-ciklus egyik köztes terméke. Ez azt jelenti, hogy a glikolízis korlátozott lesz, amikor a Kreb-ciklusból nagy mennyiségű ATP keletkezik.
 3. ábra – Az alloszterikus gátlás és aktiválás mechanizmusát bemutató ábra.
3. ábra – Az alloszterikus gátlás és aktiválás mechanizmusát bemutató ábra.Foszforiláció
A foszforiláció egy másik mechanizmust biztosít, amellyel az enzimek gátolhatók. Ez jellemzően kináz enzimek hatására történik, amelyek a helyzettől függően gátolhatnak vagy aktiválhatnak egy enzimet. A kináz enzimek egy foszfátcsoportot hasítanak le az ATP-ből, és azt az enzimhez kötik. Azokban a helyzetekben, amikor ez az enzimaktivitás növekedését eredményezi, kaszkádreakciót hoz létre, lehetővé téve, hogy egy kis ingerből nagy válasz keletkezzen.
Zimogének
Az enzimek inaktív állapotban is szekretálódhatnak, ezeket zimogéneknek nevezzük. A zimogének egy hasznos mechanizmus, amely lehetővé teszi az enzimek biztonságos szállítását különböző helyekre anélkül, hogy az enzim útközben aktívvá válna és ellátná a funkcióját. A fehérjében lévő aminosavak hozzáadása miatt maradnak inaktívak. Ezért egy zimogén aktiválásához egy másik enzimnek le kell hasítania ezeket a további aminosavakat. Például a kimotripszinogént a hasnyálmirigy szintetizálja, mégis inaktiválódik és nem tud működni. A bélrendszerbe jutva egy másik enzim (tripszin) lehasítja a további aminosavakat, így keletkezik az aktivált forma, a kimotripszin.
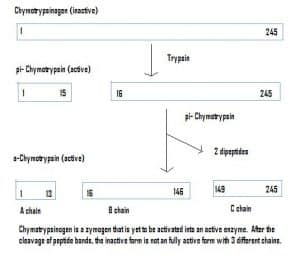 4. ábra – A kimotripszinogén aktiválódását bemutató ábra a gyomor-bélrendszerben és az egyes szakaszokban résztvevő enzimek.
4. ábra – A kimotripszinogén aktiválódását bemutató ábra a gyomor-bélrendszerben és az egyes szakaszokban résztvevő enzimek.Klinikai jelentőség – Farmakokinetika
Az enzimgátlás legfontosabb klinikai felhasználása a gyógyszerek alkalmazása. Az ACE-gátlók a magas vérnyomás gyakori kezelésére szolgálnak. Az angiotenzin I az angiotenzin konvertáló enzim (ACE) hatására alakul át angiotenzin II-vé. Az Angiotenzin II azonban számos olyan hatást okoz, amely a vérnyomás emelkedéséhez kapcsolódik. Ezért az ACE-gátlókat úgy tervezték, hogy kompetitív módon gátolják az ACE hatását, ami kevesebb Angiotenzin II képződését és alacsonyabb vérnyomást eredményez.
A penicillin irreverzibilisen kötődik a DD-transzpeptidáz nevű enzim aktív helyéhez. A DD-transzpeptidáz felelős a bakteriális sejtfal szintézisének utolsó lépéséért. Ennek az enzimnek a gátlásával a baktériumok nem tudnak sejtfalat szintetizálni, és ezért nem tudják fenntartani az életet.
Végezetül a cianid egy példa a nem kompetitív inhibitorokra. A cianid az elektrontranszportlánc utolsó enzimjéhez kötődik, és megakadályozza, hogy ez az enzim katalizálja az oxigénből vízzé történő reakciót. Ez megakadályozza az elektronok lefelé áramlását az elektrontranszportláncban, és nem tud ATP keletkezni, ami a halálhoz vezet.




