Frontiers in Neuroscience
Introduction
A felnőttkori hippokampuszban, az agy térbeli navigációban és memóriaképzésben részt vevő régiójában (Buzsaki and Moser, 2013) új idegsejtek termelődése a plaszticitás egy feltűnő formája, amely számos fajban, köztük az emberben is egész életen át fennmarad (Altman and Das, 1965; Eriksson et al., 1998; Moreno-Jiménez et al., 2019). A felnőttkori hippokampális neurogenezist szabályozó számos körülmény közül az egyik legmegbízhatóbb, széles körben leírt folyamat a neuronális termelés életkor által közvetített csökkenése, miközben a már meglévő neuronpopulációk a normál öregedés során állandóak maradnak (Kuhn et al., 1996; Kempermann et al., 1998; Burke és Barnes, 2010). Az öregedés számos funkciót érint az agyban, beleértve a szinaptikus átvitelt és a plaszticitást, amelyekről úgy gondolják, hogy hozzájárulnak a memóriavesztéshez (Burke és Barnes, 2006; Fan et al., 2017). Tekintettel arra, hogy a hippokampusz különösen érzékeny az életkorral összefüggő változásokra és a neurodegenerációra, az öregedés hatásainak megelőzése vagy enyhítése szempontjából fontossá válik az ebben a struktúrában a plaszticitást fokozó stratégiák megtalálása (Bartsch és Wulff, 2015). A testmozgás és a kognitív ingerek fokozzák az agy egészségét, és általában enyhítik az öregedés hatásait. Az egyik közvetlen előny a tevékenységtől függő agyi neurotrofikus faktor (BDNF) szintjének növekedéséből eredhet, amelyről kimutatták, hogy helyreállítja a szinaptikus plaszticitást, fokozza a neurogenezist és javítja a tanulást középkorú egerekben (Marlatt és mtsai., 2012; Trinchero és mtsai., 2017). A testmozgás csökkenti a mikroglia aktivációt is, növeli az aktivitásfüggő szinaptikus plaszticitást, a neurális progenitor sejtek proliferációját és felgyorsítja a felnőtt születésű szemcsesejtek (GC) fejlődését és integrációját az öregedő hippokampuszban (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Ezek a hatások hozzájárulnak a hippokampusz-függő plaszticitás helyreállításához és az adaptív viselkedéssel korrelálnak. Így azok az idős állatok, amelyek rosszul teljesítenek a térbeli tanulási és mintaszétválasztási feladatokban, edzés után javítják teljesítményüket (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
Azt, hogy a neurogenezis milyen mértékben járul hozzá a mozgás pozitív viselkedési hatásaihoz idősödő állatokban, még vizsgálják. Lehetséges, hogy a testmozgás által kifejtett neurogenezis sebességének növekedése hozzájárul a viselkedésbeli javuláshoz. De más mechanizmusok is szerepet játszhatnak (Meshi és mtsai., 2006). Az új neuronok gyorsabb integrációja az öregedő dentate gyrusban a testmozgás után, ami módosítja az új GC-k minőségét, szintén hozzájárulhat a viselkedésbeli javuláshoz. Míg a középkorú egerekben született neuronok lassan fejlődnek, a tartós önkéntes testmozgás elősegíti a dendritikus növekedést, a gerincek kialakulását és a neuronális integrációt (Trinchero et al., 2017). Hasonló hatásokat figyeltek meg a környezeti gazdagításnak (EE) való rövid ideig tartó kitettséggel (Trinchero et al., 2019). Ha több neuronális kohorszra halmozódik, a testmozgás által kiváltott gyorsított neuronális integráció jelentős hatást gyakorolhat a hippokampusz-függő tanulásra és viselkedésre. Ebben a munkában azt mutatjuk be, hogy az új GC-k több kohorszát gyorsan integrálni lehet az önkéntes futást folytató egerek már meglévő áramköreibe, és hogy ezek a hatások fennmaradnak, miután az egerek abbahagyták a futást.
Anyagok és módszerek
Egerek és műtét
C57BL/6J hím egereket ketrecenként 4-5 állatot tartottunk standard körülmények között. Nyolc hónapos (8M) egereket választottunk, mivel ezen életkoron túl a hippokampusz neurogenezisében erős hanyatlás következik be, ami kizárja a jelölt neuronok vizsgálatát (Morgenstern et al., 2008; Trinchero et al., 2017). Az egereket elaltattuk (150 μg ketamin/15 μg xilazin 10 μl sóoldatban/g), és a retrovírust steril kalibrált mikrokapilláris pipetták segítségével sztereotaxiás műtéttel a jobb dentate gyrus szeptális régiójába infundáltuk (1,5 μl 0,15 μl/perc sebességgel); koordináták a bregmától (mm-ben): -2 anteroposterior, -1,5 laterálisan és -1,9 ventrálisan. A jelzett időpontokban az agyakat fixáltuk, és metszeteket készítettünk konfokális képalkotáshoz (Trinchero et al., 2017). Az elemzésbe csak a septalis dentate gyrusból származó GC-ket vontuk be, amelyek a bregmától -0,96 és -2,30 mm között lokalizált metszeteknek feleltek meg az egér agyi atlasz szerint (Paxinos és Franklin, 2001). A kísérleti protokollokat a Fundación Instituto Leloir intézményi állatgondozási és -felhasználási bizottsága hagyta jóvá, az Orvosi Tudományok Nemzetközi Szervezeteinek Tanácsának az állatokkal végzett orvosbiológiai kutatásokra vonatkozó elvei és a laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatóban foglalt rendelkezések szerint.
Futás
A futási távolságokat minden kísérlethez vezeték nélküli futókerékkel rögzítettük. Az 1. ábra kísérleteiben az állatokat a jelzetteknek megfelelően 7 vagy 21 napig tartották futókerékkel. Ebben az állapotban az egerek ∼2 km/nap futottak. A 2., 3. ábrákon, amelyekben az egerek 1, 2 vagy 3 hónapig futottak, a megfigyelt távolság ∼10 km/nap volt.
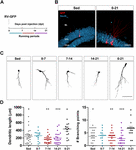
1. ábra. A hosszú, de nem rövid futási periódusok felgyorsítják az új GC-k morfológiai érését. (A) Kísérleti elrendezés. Az RV-GFP injekciót 1 hetes önkéntes futásnak való kitettség követte a jelzett ablakokban vagy a kísérlet teljes időtartama alatt (0-21 dpi). (B) Reprezentatív képek a GFP-t (piros) expresszáló 21 dpi GC-kről, amelyek az ülő és a 0-21 futó csoportokból készültek. A NeuN (kék) a szemcsesejtes réteget (GCL) jelöli (ML, molekuláris réteg). Méretsáv, 50 μm. (C) Reprezentatív konfokális képek 21 dpi GFP-GC-kről a különböző csoportok esetében. Méretsáv, 50 μm. (D) Dendritikus komplexitás (hossz és elágazási pontok) a különböző futóablakok esetében. ∗, ∗∗∗ és ∗∗∗∗ jelöli a p < 0,05, p < 0,01 és p < 0,001 a 0-21 futócsoporthoz képest a Kruskal-Wallis-teszt és a Dunn-féle post hoc teszt után. A 7 napig futó csoportok között nem találtunk különbséget. Mintavételek (neuronok/egér): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) és 15/3 (0-21). A vízszintes sávok az átlagot ± SEM jelölik. A nyitott körök megfelelnek a példa neuronoknak.
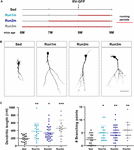
2. Ábra. A futás hatása a különböző neuronális kohorszokra. (A) Kísérleti elrendezés. Az RV-GFP injekciót 3 hetes futás követte, amelyet ülő körülmények (Run1m), 1 (Run2m) vagy 2 hónapos futás (Run3m) előztek meg. Minden csoportot ülő egerekkel (Sed) hasonlítottunk össze. A teljes dendritikus hosszúságot 21 dpi-nél elemeztük. (B) Reprezentatív konfokális képek GFP-GC-kről. Méretsáv, 50 μm. (C) Dendritikus komplexitás (hossz és elágazási pontok) a különböző futási ablakok esetében. ∗, ∗∗ és ∗∗∗∗ a p < 0,05, p < 0,01 és p < 0,001 a Sed-hez képest a Kruskal-Wallis teszt és a Dunn-féle post hoc teszt után. Mintavételek (neuronok/egér): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) és 15/3 (Run3m). A vízszintes sávok az átlag ± SEM értéket jelölik. A nyitott körök megfelelnek a példa neuronoknak.

3. Ábra. A krónikus edzés tartós hatásai. (A) Kísérleti elrendezés. Az RV-GFP injekciót 3 hetes futás követte (Run1m) vagy 1 hónapos edzés előzte meg (Run-1m) vagy 1 hónapos edzés és 1 hónap futókerék nélkül (Run-2m). Minden csoportot ülő egerekkel (Sed) hasonlítottunk össze. A teljes dendritikus hosszúságot 21 dpi-nél elemeztük. (B) Reprezentatív konfokális képek a jelölt GC-kről. Méretsáv, 50 μm. (C) Dendritikus komplexitás (hossz és elágazási pontok) a különböző futóablakok esetében. ∗∗∗∗ a p < 0,001 a Sed-hez képest a Kruskal-Wallis teszt és a Dunn-féle post hoc teszt után. Mintavételek (neuronok/egér): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) és 18/3 (Run-2m). (D) A CA3-ban az MFB morfológiáját elemeztük a Run1m és Run-1m csoportok esetében, és összehasonlítottuk a Sed-hez képest. Reprezentatív konfokális képek. Méretsáv, 5 μm. (E) ∗ és ∗∗ jelöli a p < 0,05 és p < 0,01 a Kruskal-Wallis teszt és a Dunn-féle post hoc teszt után. Mintaméretek: 27/4 (Sed), 32/4 (Run1m) és 18/4 (Run-1m). A vízszintes sávok az átlagot ± SEM jelölik. A nyitott körök megfelelnek a példa boutonoknak.
Immunofluoreszcencia
Az immunfestést 60μm-es szabadon lebegő koronális metszeteken végeztük. Az antitesteket 3% szamárszérumot és 0,25% Triton X-100-at tartalmazó tris-pufferelt sóoldatban (TBS) alkalmaztuk. Az immunfluoreszcenciát anti GFP (nyúl poliklonális; 1:500; Invitrogen), anti NeuN (egér monoklonális; 1:50; F.H. Gage (Salk Institute for Biological Studies, La Jolla, CA, Egyesült Államok) ajándéka), szamár antinyúl Cy3 és szamár antiegér Cy5 antitestekkel (1:250; Jackson Immuno Research Laboratories) végeztük.
Konfokális mikroszkópia
A dendritikus hosszmérésekhez a képeket (40×; NA 1,3; olaj-immersion) 60μm vastagságú metszetekről szereztük be, 35-50 optikai szeletet tartalmazó Z halmokat véve, airy unit = 1 0,8μm-es időközönként (Trinchero et al, 2017). A dendritikus hosszúságot ezután az LSM Image Browser szoftver segítségével mértük a háromdimenziós rekonstrukciók egyetlen síkra történő vetítéséből a GFP-t expresszáló GC-kben. A CA3 régióban lévő GFP-jelölt MFB-k képeit 0,4μm-es intervallumokban (63×; NA 1,4; olaj-immersziós) és 6-os digitális nagyítással vettük fel. A filopodiák területét és számát a háromdimenziós rekonstrukciók egyetlen síkra történő vetítéséből elemeztük. A következő kritériumoknak megfelelő mohaszálas boutonokat (MFB) választottuk ki a számszerűsítéshez: (i) a bouton átmérője >háromszor nagyobb volt, mint a rost átmérője, (ii) a bouton legalább az egyik végén kapcsolódott a mohaszálhoz (Toni et al., 2008). A filopodiákat nagy mohás végződésekből (1 μm < hossza < 20 μm) eredő nyúlványokként azonosították (Acsady és mtsai., 1998). A filopodiális nyúlványokat a terminálonkénti nyúlványok számának megszámlálásával mértük. A képfelvétel és a morfológiai tulajdonságok elemzése során minden vizsgált kísérleti csoportot vakon kezeltünk.
Statisztikai elemzés
Az adatok – eltérő rendelkezés hiányában – átlag ± SEM-ben vannak megadva. A normalitást a Shapiro-Wilks-teszt, a D’Agostino-Pearson omnibusz teszt és a Kolmogorov-Smirnov teszt segítségével értékeltük, 0,05 p-értékkel. Ha az adatok megfeleltek a normalitási teszteknek (Gauss-eloszlás és egyenlő szórás), a jelzetteknek megfelelően párosítatlan t-próbát alkalmaztunk Welch-korrekcióval vagy ANOVA-t Bonferroni post hoc tesztjével. Azokban az esetekben, amelyek nem feleltek meg a normalitásnak, nem parametrikus teszteket alkalmaztunk az alábbiak szerint:
Eredmények
Már korábban kimutattuk, hogy a futás felgyorsítja az új GC-k fejlődését és funkcionális integrációját az öregedő hippokampuszban (Trinchero et al., 2017). Most azt vizsgáltuk, hogy ez a fajta plaszticitás igényel-e tartós, időben felhalmozódó aktivitási szintet, vagy a futás rövidebb időszakai is gyorsabb integrációt válthatnak ki, ahogyan azt korábban az EE-nek való kitettség esetében megfigyeltük (Trinchero et al., 2019). E kérdés megválaszolásához új neuronális kohorszokat jelöltünk középkorú egerekben (8 hónapos korban; 8M) egy GFP-t kifejező retrovírus (RV-GFP) segítségével. Az egerek a neuronális fejlődés különböző ablakaiban 1 héten keresztül futó kereket használhattak, vagy a neuronális növekedés teljes intervallumában (3 hét; 1A,B ábra) futhattak. Ahogy korábban leírtuk, az új GC-k lassú fejlődést mutattak az ülő egerekben, ami 3 hét alatt rövid, kevés elágazással rendelkező dendriteket eredményezett. Az egyhetes futás nem változtatta meg az új GC-k általános megjelenését egyik vizsgált intervallumban sem (1C,D ábra). Ezzel szemben a teljes 3 hetes intervallumon át tartó futás a dendritek hosszának és elágazásának növekedését eredményezte, ami összhangban van a felgyorsult neuronális integrációval.
A mozgás megfigyelt hatásait egyetlen neuronális kohorszon, a retrovírusosan jelölteken teszteltük. Mivel azonban folyamatosan új GC-k keletkeznek, elképzelhető, hogy az edzés időszakán belül különböző időpontokban született GC-ket is befolyásolhatja az aktivitás. Ennek a hipotézisnek a tesztelésére egy egyszerű stratégiát alkalmaztunk az edzéskezdet tekintetében különböző időpontokban született neuronális kohorszok jelölésére úgy, hogy az egereket különböző időközönként futókeréknek tettük ki, de mindig a neuronális szerkezetet elemeztük 3 héttel a retrovírus beadása után (az egyszerűség kedvéért 1m-nek neveztük). Így három kohorszot hasonlítottunk össze; egy 3 hétig futó, közvetlenül az edzés megkezdésekor megjelölt (Run1m), egy 2 hónapig futó, 1 hónappal az edzés megkezdése után megjelölt (Run2m), és egy 3 hónapig futó, 2 hónappal az edzés megkezdése után megjelölt (Run3m) (2A ábra). Minden körülmények között hasonló mértékű neuronális növekedést figyeltünk meg az ülő egerekhez képest, ami azt jelzi, hogy az önkéntes futást végző középkorú egér agyában született összes neuronális kohorsz gyors növekedésen és integráción megy keresztül (2B,C ábra). A Run3m egerek GC-inek dendritikus fái kissé hosszabbak voltak, mint a Run1m vagy Run2m egereké, ami arra utal, hogy a neuronális integráció elősegítése olyan mechanizmusra válaszolhat, amelynek hatása idővel felhalmozódik. Mégis, 1 hónap futás közel maximális hatást eredményezett a GC fejlődésére.
Ezután megvizsgáltuk a testmozgás hatását az öregedő agyban az aktivitás befejezése után született neuronális kohorszokra. Összehasonlítottuk, hogy a 3-4 héten át tartó futás hogyan befolyásolja a közvetlenül az edzés kezdetén (Run1m), a végén (Run-1m) vagy 1 hónappal az edzés befejezése után (Run-2m; 3A ábra) született új GC-k fejlődését. Meglepő módon a futási időszak elején vagy végén született neuronális kohorszok hasonlóan reagáltak (3B,C ábra). Ezzel szemben az 1 hónappal az edzés vége után született kohorszok (Run-2m) csak finom hatást mutattak.
Az áramkörbe való teljes integrálódás érdekében a GC-k nagy MFB-ken keresztül glutamaterg gerjesztő kapcsolatokat hoznak létre a CA3 piramissejteken, és az ezekből a terminálokból eredő filopodiális nyúlványokon keresztül GABAerg feedforward gátlást toboroznak a piramissejteken (Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Míg a konfokális elemzés nem mutatott ki változásokat a Run-1m vagy Run1m-ben született neuronok MFB-jének területén a kontrollokhoz képest, a filopódiumok/MFB-k száma ∼100%-kal nőtt (3D,E ábra). Ezek az eredmények azt jelzik, hogy a fizikai edzés specifikusan növeli az új GC-kből a gátló helyi hálózatra való kapcsolódást (Trinchero és mtsai., 2019).
Diszkusszió
A felnőttkori neurogenezis komplex fejlődési lépések sorozatát foglalja magában, amely új információfeldolgozó egységek integrációját eredményezi. A szubgranuláris zóna neurális őssejtjei nyugalmi állapotukból kilépve proliferáló neurális progenitorsejtekké válnak, amelyek bővítik a prekurzorpopulációt (tranzit amplifikáló sejtek) (Bonaguidi és mtsai., 2012). Az elődsejtek neuronokat hoznak létre, amelyek vándorolnak, fejlődnek és integrálódnak az áramkörbe. Ebben a meghosszabbított időablakban az apoptotikus sejthalál miatt jelentősen csökken a neuronális pool. Az önkéntes testmozgás és az EE erős stimulációt jelentenek a felnőttkori hippokampusz neurogenezis fokozására rágcsálókban egész életük során (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). A neurogenezis csökken az öregedő agyban, főként a progenitorsejt-állomány méretének csökkenése következtében. Mind a futás, mind az EE ellensúlyozhatja az öregedő állatokban jelentett csökkent neurontermelődést, különböző mechanizmusokon keresztül hatva (Kempermann és mtsai., 2010). A futás két szinten hat a neurogenezis fokozására: növeli a neurális progenitorsejtek proliferációs sebességét (van Praag et al., 1999b, 2005; Cooper et al., 2018), és felgyorsítja a fejlődő neuronok érését és funkcionális integrációját (Trinchero et al., 2017). Az EE növeli a túlélést és felgyorsítja az új GC-k érését is, de nem befolyásolja a proliferációt (Trinchero et al., 2017, 2019).
A futás szintén elősegíti a neuronális konnektivitás újrakábelezését és az intrinzik tulajdonságok modulációját az új GC-kben a fejlődés első hetében fiatal felnőtt egerekben (Sah et al., 2017). Nemrégiben beszámoltunk egy kritikus időszakról a GC-k érésének második hetében az öregedő állatokban, amelyben az EE dendritikus növekedést és az új neuronok gyorsabb integrációját indukálja az áramkörbe (Trinchero et al., 2019). Itt azt kérdeztük, hogy az 1 héten át tartó futás a GC-k fejlődésének bármelyik időpontjában befolyásolja-e az integrációjukat, de nem találtunk hatást (1. ábra). A neurogenezis szabályozásához a teljes 3 hetes futási periódusra volt szükség. A rövid távú moduláció hiánya olyan mechanizmusra utal, amelyet olyan tényezők közvetítenek, amelyeknek fel kell épülniük ahhoz, hogy észrevehető változásokat fejtsenek ki. Érdekes módon az önkéntes testmozgás fokozza a BDNF termelését, amely hetek alatt felhalmozódik, mielőtt elér egy olyan platószintet, amely maximális hatást fejt ki (Vecchio és mtsai., 2018). Bár a neurotrofinok kulcsfontosságú közvetítők, az itt megfigyelt hatásokat valószínűsíthetően több mechanizmus közvetíti. A testmozgás fokozza az elektromos aktivitást a gyrus dentatusban, növeli a véráramlást és modulálja a neuroinflammációt (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). Az egyéb mechanizmusok hozzájárulása további vizsgálatokat igényel.
Ezekben azt mutatjuk be, hogy az öregedő egerekből származó ∼3 hetes GC-k, amelyek krónikusan (akár 3 hónapig) futó keréknek vannak kitéve, teljesen kifejlett fenotípust mutatnak hosszú és összetett dendritikus arborizációval, hasonlóan a fiatal felnőtt egerekben létrehozott új GC-khez (2. ábra). A fiatal felnőtt és középkorú egerek érett GC-jei a fejlődés végére elérik az egyenértékű dendritikus hosszúságot és komplexitást, ami hasonló az EE-nek vagy futásnak kitett öregedő egerek 3 hetes GC-jeihez (Piatti et al., 2011; Trinchero et al., 2017, 2019). Ez a felhalmozott bizonyíték a futás által kiváltott érési sebesség egyértelmű gyorsulása mellett szól.
A neuronális kimenet szintjén a futás elősegítette a filopodiális nyúlványok gyors növekedését, de nem módosította az MBF-ek méretét (3D,E ábra). Ez az eredmény arra utal, hogy az új GC-k gyorsan integrálódnak, de kimenetük inkább a CA3-ban lévő (filopodiák által kontakcióba hozott) GABAerg interneuronok aktiválására irányulhat, mint az MFB-k által kontakcióba hozott piramissejtekre (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Meglepő, hogy az EE az öregedő egerekben mind az MFB-k méretének, mind a filopodiális nyúlványok számának jelentős növekedését idézte elő, ami összhangban van a neuronális kimenet kiegyensúlyozottabb modulációjával (Trinchero et al., 2019). Feltételezésünk szerint az EE okozta változások a specifikus szinapszisok aktivitásfüggő átalakítását foglalják magukban, amelyek megerősödnek a térbeli jelek kódolásához (Nicoll és Schmitz, 2005; Holtmaat és Svoboda, 2009). Ezzel szemben a futás általános ösztönzést jelenthet az új GC-k számára, hogy felkészüljenek a specifikus célpontokhoz való kapcsolódásra, amikor a kódolás szükségessé válik, miközben megőrzi a GABAerg interneuronok gátló tónusát, amely a posztszinaptikus aktivitást korlátozó mechanizmusként működhet, amíg az új GC megfelelően össze nem épül a környező hálózatban.
Eredményeink azt mutatják, hogy az öregedő agy neurogén jeleket generál, amikor az egerek hosszabb ideig (hónapokig) folytatják a futást. Ebben az összefüggésben a futó egerekben született későbbi neuronális kohorszok gyorsan fejlődnek és integrálódnak, lehetővé téve az öregedő áramkörök számára, hogy jelentős számú új neuron felhalmozódjon (4. ábra). Az új GC-k folyamatos beépülése, amelyek jellemzői hasonlítanak a fiatalabb egereknél előforduló tulajdonságokra, egy megfiatalított hippokampuszt eredményez olyan neuronokkal, amelyek felkészülhetnek a jövőbeli tapasztalatokra való reagálásra.
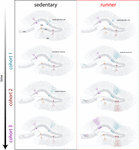
4. ábra. A hippokampusz-hálózat futás által kiváltott megfiatalodása középkorú egerekben. A neuronális integráció időbeli lefolyásának sematikus ábrázolása ülő (balra) és futó (jobbra) egerekben hosszabb ideig tartó önkéntes edzésintervallumok után. A gyrus dentatus subgranularis zónájában a radiális-glia-szerű sejtek (RGL) nyugalmi állapotban maradnak (fent). Az ülő, öregedő egerek alacsony neurogenezisrátát mutatnak, és az új idegsejtek lassan fejlődnek (a reprezentatív kohorszokat különböző színekkel jelöltük). Futó egerekben az új GC-k termelődése fokozódik, és ezek az új egységek gyorsabban fejlődnek és integrálódnak, így hosszabb idő alatt kumulatív módon bővítik az ideghálózatot. Végső soron a teljesen érett neuronok ezen új kohorszai bekapcsolódnak, hogy igény szerint feldolgozzák az információt.
Tágabb perspektívából nézve, a modern társadalomhoz kapcsolódó hosszú élettartam növekedése a kognitív hanyatlás nagyobb kockázatával jár együtt. Így fontossá válik a testmozgás agyműködésre gyakorolt jól ismert előnyeinek hátterében álló mechanizmusok megértése. Emellett hosszú távú különbségek lehetnek az élet különböző szakaszaiban testmozgást gyakorló és a folyamatosan testmozgást végző egyének között a neurodegeneratív betegségek kialakulásának kockázatát csökkentő tényezők tekintetében (Llorens-Martin, 2018). Eredményeink azt mutatják, hogy a folyamatos futás elősegíti számos neuronális kohorsz integrációját, így figyelemre méltó módon emeli a hálózat komplexitását. A hippokampuszban az új neuronok integrációjának hatékonyságát növelő különböző stratégiák tervezése a plaszticitás ígéretes mechanizmusaként szolgálhat az egészséges és beteg öregedő agyban bekövetkező kognitív hanyatlás végső soron történő javítására. Végül, az ilyen felgyorsult neuronintegráció és fejlődés különböző aspektusainak hátterében álló mechanizmusok boncolgatása sokat tanulhatunk az öregedő agyban az ideghálózatok plaszticitásának lehetőségeiről.
Adatok elérhetősége
A tanulmány eredményeit alátámasztó adatok indokolt kérésre elérhetők a megfelelő szerzőtől.
Etikai nyilatkozat
Az állatkísérletet a Leloir Intézet laboratóriumi állatok felhasználásával és gondozásával foglalkozó bizottsága felülvizsgálta és jóváhagyta.
A szerzők hozzájárulása
MT és MH végezte a kísérleteket és elemezte az adatokat. MT, MH és AS tervezte a kísérleteket és írta a kéziratot. AS pénzügyi támogatást nyújtott.
Finanszírozás
Ezt a munkát az Argentin Tudományos és Technológiai Ügynökség (Grant# PICT2015-3814), a National Institute of Neurological Disorders and Stroke és a Fogarty International Center (Grant# R01NS103758) támogatta AS számára, aki a Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) kutatója. MT-t egy CONICET-ösztöndíj támogatta.
Enyilatkozat az érdekellentétről
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Köszönet
Köszönjük AS laboratórium tagjainak az értő beszélgetéseket.
Acsady, L., Kamondi, A., Sik, A., Freund, T. és Buzsaki, G. (1998). A GABAerg sejtek a mohás rostok fő posztszinaptikus célpontjai a patkány hippokampuszban. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). A posztnatális hippokampusz neurogenezis autoradiográfiás és szövettani bizonyítékai patkányokban. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., and Wulff, P. (2015). A hippokampusz az öregedésben és a betegségben: a plaszticitástól a sérülékenységig. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). Egységesítő hipotézis az emlős neurális őssejtek tulajdonságairól a felnőtt hippokampuszban. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Neurális plaszticitás az öregedő agyban. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Szeneszcens szinapszisok és a hippokampusz áramkörök dinamikája. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Memória, navigáció és théta ritmus a hippokampusz-entorhinális rendszerben. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). Futás a hippokampusz plaszticitásért. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016). Javíthatja-e a testmozgás idős korban a memóriát és a hippokampusz működését? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenezis a felnőtt emberi hippokampuszban. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). A hippokampusz öregedésének mechanizmusai és a fiatalítás lehetőségei. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). A felnőtt hippokampusz neurogenezis fordítottan korrelál a mikrogliával az önkéntes futás és az öregedés körülményei között. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., and Svoboda, K. (2009). Tapasztalatfüggő strukturális szinaptikus plaszticitás az emlősök agyában. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). A futás csökkenti a stresszt és fokozza a sejtgenezist idős egerekben. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Miért és hogyan segíti elő a fizikai aktivitás a tapasztalatok által kiváltott agyi plaszticitást. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). Tapasztalat-indukált neurogenezis az öregedő gyrus dentatusban. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., and Kempermann, G. (2006). A testmozgás megakadályozza a prekurzorsejtek aktivitásának korral összefüggő csökkenését az egér dentate gyrusban. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). A felnőtt hippokampusz proliferáló sejtjeinek alpopulációi eltérően reagálnak a fiziológiás neurogén ingerekre. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., and Gage, F. H. (1996). Neurogenezis a felnőtt patkány gyrus dentatusában: a neuronális progenitorok proliferációjának életkorral összefüggő csökkenése. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Új idegsejtek edzése az Alzheimer-kór legyőzésére. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). A futás a középkorban javítja a memóriafunkciót, a hippokampusz neurogenezist és a BDNF szintjét nőstény C57BL/6J egerekben. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). A hippokampusz neurogenezis nem szükséges a környezeti gazdagodás viselkedési hatásaihoz. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). A felnőtt hippokampusz neurogenezise bőséges neurológiailag egészséges alanyokban, és meredeken csökken az Alzheimer-kórban szenvedő betegeknél. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., and Schinder, A. F. (2008). Újdonsült szemcsesejtek az öregedő gyrus dentatusban. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). Szinaptikus plaszticitás a hippokampusz mohaszál szinapszisaiban. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). A hosszú távú futópad-expozíció véd az életkorral összefüggő neurodegeneratív változások ellen a patkány hippokampuszban. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). Az egéragy sztereotaxiás koordinátákban. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). A neuronális érés időzítését a felnőtt hippokampuszban a helyi hálózati aktivitás modulálja. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., and Frankland, P. W. (2015). A felnőttkori sejtkapcsolatok fejlődése az excitáló és gátló sejtpopulációkkal a hippokampuszban. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., and van Praag, H. (2017). A futás újraszervezi az egyhetes felnőttkori hippokampusz neuronok áramköreit. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., and Ormerod, B. K. (2013). A napi testmozgás javítja a memóriát, serkenti a hippokampusz neurogenezist és modulálja az immun- és neuroimmun citokineket öregedő patkányokban. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Az intakt, felnőttkorban született neuronok zökkenőmentes rekonstrukciója sorozatos végblokkos képalkotással komplex axonális irányítást és fejlődést mutat a felnőtt hippokampuszban. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). A felnőttkori gyrus dentatusban született neuronok funkcionális szinapszisokat képeznek a célsejtekkel. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Az új szemcsesejtek nagyfokú plaszticitása az öregedő hippokampuszban. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). A felnőttkori neuronok tapasztalatfüggő strukturális plaszticitása az öregedő hippokampuszban. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). A futás fokozza a neurogenezist, a tanulást és a hosszú távú potenciálást egerekben. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). A futás növeli a sejtproliferációt és a neurogenezist a felnőtt egér dentate gyrusban. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., and Gage, F. H. (2005). A testmozgás fokozza a tanulást és a hippokampusz neurogenezist idős egerekben. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., and Aubert, I. (2018). A testmozgás neuroprotektív hatásai: az egészséges agy fenntartása az öregedés során. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Az edzés fokozza a neurális őssejtek proliferációját és a neuronális progenitor sejtek neurit növekedését és túlélését középkorú egerek dentate gyrusában. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., and Hen, R. (2015). A futás megmenti a félelem-alapú kontextuális diszkriminációs deficitet idős egerekben. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). A futás által kiváltott memóriajavulás korrelál a vékony gerincek megőrzésével az idős C57BL/6 egerek CA1 hippokampusz területén. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




