Frontiers in Oncology
Introduction
A glioblastoma és az anaplasztikus asztrocitóma (ANA) a két leggyakoribb primer agydaganat felnőtteknél (1). Az előfordulási arányok valóban növekednek, különösen az idősek körében (1-3). A klinikai gyakorlatban a műtét vagy biopszia előtt nehéz megkülönböztetni a glioblasztómás betegeket az ANA-s betegektől, mivel a két daganat tünetei és jelei viszonylag egységesek és nem specifikusak (4, 5). A kezelésük azonban különbözik, például a kemoterápiás protokoll, az adagolás és a beadás módja (6). Például az ANA-ban (WHO III. fokozat) szenvedő betegek esetében a rezekció vagy biopszia után sugárterápia vagy TMZ alkalmazása javasolt; míg az újonnan diagnosztizált glioblasztómás (WHO IV. fokozat) betegek esetében sugárterápia plusz egyidejű TMZ, majd adjuváns TMZ. Korábbi tanulmányok szerint a glioblasztóma és az ANA a normális agyszövetbe való behatolással növekszik, a cerebrospinalis folyadékban (CSF) terjed, és túlterjed az egyetlen carotis vagy vertebralis artéria eloszlásán, így mindkettő rosszul reagál az orvosi kezelésre, és a felnőttek körében a rák okozta halálozás vezető okai (7, 8). Emellett a glioblasztóma és az ANA prognózisa is eltérő. Az idősebb populációban nincs jelentős különbség a glioblasztóma és az ANA prognózisa között, de a különbség a fiatalabb populációban fennállhat (9). Ezért nehéz, de döntő fontosságú a glioblasztóma és az ANA megkülönböztetése.
A mágneses rezonancia képalkotás (MRI) a glioblasztóma és az ANA preoperatív diagnózisában az optimális neuroimaging a multiplanáris képesség és a kiváló lágyrészkontraszt miatt. Bár egyes tanulmányok kimutatták, hogy a gyűrűszerű fokozódás és nekrózis jelenléte glioblasztómára utal, a legtöbb esetben mind a glioblasztóma, mind az ANA szabálytalan alakzatokként jelenik meg az MR-felvételeken (T2-súlyozott szekvencián hiperdenzív, T1-súlyozott szekvencián hipodenz), különböző mértékű Gd-alapú kontrasztfokozódással és ödémával, amelyek közül a különbségek emberi szemmel általában nem érzékelhetőek (10-12).
A textúraelemzést (TA), más néven radiomikát, a közelmúltban széles körben alkalmazták különböző területeken. A kutatók úgy találták, hogy a TA megvalósítható és ígéretes módszer a differenciáldiagnózis megkönnyítésére, mivel lehetővé tette az MR-képekből további, az emberi értékelés számára láthatatlan mennyiségi információk megszerzését (13-15). A TA leírja a voxelértékek gyakorisági eloszlását és térbeli szerveződését, hogy feltárja a tumorszövet lehetséges különbségeit (16). Korábbi tanulmányok a TA alkalmazásának megvalósíthatóságát vizsgálták a differenciáldiagnosztikában, a tumorok altípus szerinti osztályozásában és a tumorszövet heterogenitásának kimutatásában (17-19). Tudomásunk szerint a TA alkalmazásáról a glioblasztóma és az ANA közötti differenciáldiagnosztikában még nem számoltak be. Jelen tanulmány célja az volt, hogy értékeljük az MRI textúraelemzés diszkriminatív képességét gépi tanulási algoritmusok segítségével a glioblasztóma és az ANA megkülönböztetésére.
Anyagok és módszerek
Páciensek kiválasztása
Retróspektív módon átnéztük intézményünk adatbázisát, és 2015 januárjától 2018 decemberéig minden szövettanilag glioblasztómaként vagy ANA-ként diagnosztizált beteget átvilágítottunk. A minősített betegek támogathatósági kritériumai a következők voltak: (1) glioblastoma vagy ANA meggyőző szövettani diagnózisa; (2) kidolgozott elektronikus orvosi dokumentáció, különösen patológiai anyag; (3) diagnosztikus MR-vizsgálat intézményünkben a műtéti reszekció előtt. Kizáró kritériumok voltak: (1) intrakraniális betegség (pl. agyi trauma, intrakraniális fertőzés vagy más típusú agydaganat), figyelembe véve a hegszövet interferenciáját a képek intenzitásában; (2) mozgásartefaktumok jelenléte az MRI-n; (3) MR-vizsgálatot megelőzően végzett kezelések (pl. műtét, kemoterápia vagy sugárkezelés); (4) olyan betegek, akik nem teljesítették a glioblasztóma vagy ANA diagnózisának kritériumait a WHO 2016-os osztályozási rendszere szerint. Egy 10 éves tapasztalattal rendelkező vezető neuropatológus megítélte, hogy a beteg megfelel-e a glioblasztóma vagy ANA kritériumainak (a WHO 2016-os osztályozási rendszere). Az intézményi felülvizsgálati bizottság jóváhagyta ezt a retrospektív vizsgálatot. A vizsgálatba bevont résztvevőktől írásbeli tájékozott beleegyezést szereztek be. A Sichuan Egyetem etikai bizottsága és intézményünk radiológiai osztálya jóváhagyta a statisztikák felhasználását ehhez a tanulmányhoz.
MR képfelvétel
A tanulmányba bevont összes beteg esetében rendelkezésre álltak kontrasztos T1-súlyozott szekvenciák, amelyeket 3,0T Siemens Trio szkenneren nyertünk a következő paraméterekkel: TR/TE/TI = 1900/2,26/900 ms, Flip-szög = 9 °, 20 axiális szelet vastagsága = 5 mm, axiális FOV = 25,6 × 25,6 cm2 és adatmátrix = 256 × 256. A kontrasztos T1-súlyozott képalkotás során gadopentetát-dimeglumin (0,1 mmol/Kg) volt a kontrasztanyag, és a kontrasztos MRI többirányú adatait a 90-250 s közötti folyamatos intervallumidő alatt gyűjtöttük.
Textúra kinyerés
Vizsgálatunkban a LifeX csomagot (http://www.lifexsoft.org) használtuk a textúrajellemzők kinyerésére. A további elemzéshez a kontraszt utáni T1-súlyozott (T1C) képeket választottuk a tumor helyének és határának egyértelmű ábrázolása miatt (20). Az érdeklődési területet (ROI) manuálisan szeletről szeletre rajzoltuk meg az axiális síkban az elváltozások mentén a kontrasztfokozott képeken a textúrajellemzők kinyerése érdekében. A ROI-t két tapasztalt idegsebész rajzolta meg, akik vakok voltak a betegek kórlapjaira és szövettani diagnózisára, majd egy vezető radiológus és egy vezető idegsebész szerkesztette meg. A nézeteltéréseket a vezető radiológussal és a vezető idegsebésszel való megbeszélés és konzultáció útján kezelték. Az MRI-képekből összesen 40 textúrajellemzőt vontak ki, beleértve a minValue, meanValue, maxValue, stdValue és a hat mátrixból származó paramétereket: Hisztogram-alapú mátrix (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone length matrix (GLZLM) és Neighborhood gray-level dependence matrix (NGLDM).
Features Selection
A hat kiválasztott mátrixból összesen 40 texturális jellemzőt vontak le. A 40 textúrajellemző magyarázatát az 1. kiegészítő táblázat tartalmazza. A textúrajellemzők statisztikáit a 2. kiegészítő táblázat tartalmazza. A jellemzők kiválasztását a releváns jellemzők meghatározása és ezáltal a túlillesztés elkerülése érdekében végeztük. Emellett az ebben a tanulmányban alkalmazott gépi tanulási algoritmus nem tudta mind a 40 textúrajellemzőt figyelembe venni az elemzés során. Az optimális textúrajellemzők kiválasztására három független jellemző-kiválasztási módszert alkalmaztunk, köztük a távolsági korrelációt, a legkisebb abszolút zsugorodást és kiválasztási operátort (LASSO), valamint a gradiens korrelációs döntési fát (GBDT). Ezáltal a textúrajellemzők három részhalmaza jött létre, amelyek három különböző adathalmazt alkottak.
Klasszifikáció
A lineáris diszkriminanciaanalízis (LDA) egy robusztus osztályozási módszer két osztály elkülönítésére a prediktorok azon lineáris kombinációjának keresésével, amely maximalizálja a csoportok közötti elkülönítést. Ebben a tanulmányban három osztályozási modellt hoztunk létre az LDA algoritmus alapján: Távolsági korreláció + LDA, LASSO + LDA és GBDT + LDA. Az adatkészleteket az LDA algoritmusba tápláltuk, illetve egymástól függetlenül. Minden adathalmazt véletlenszerűen 4:1 arányban osztottunk képzési és validálási csoportra. A képzési csoport által kiképzett modellt ezután a független validálási csoportra alkalmaztuk, hogy értékeljük a teljesítményét. Az LDA algoritmus robusztusságának felmérése érdekében az eljárást 100 cikluson keresztül megismételtük különböző, véletlenszerű és független esetkiosztással. A szövettanból származó valós hozzárendelés és az LDA algoritmus előrejelzéseinek felhasználásával konfúziós mátrixot határoztunk meg. A modellek diszkriminatív képességének feltárása érdekében kiszámítottuk a standard érzékenységet, a specificitást, a vevői működési jelleggörbe alatti területeket (AUC) és a pontosságot mind a gyakorló, mind a validáló csoportra. Három modell (távolsági korreláció + LDA, LASSO + LDA és GBDT + LDA) összehasonlítását végeztük el a glioblasztóma és az ANA optimális diszkriminatív modelljének meghatározása érdekében. Az MRI-osztályozás folyamatábrája a textúrajellemzők alapján az 1. ábrán látható.
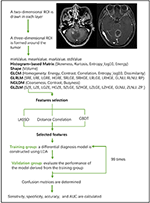
1. ábra. Az MRI-osztályozás folyamatábrája a textúrajellemzők alapján. ANA, anaplasztikus asztrocitóma; LDA, lineáris diszkriminanciaanalízis; MRI, mágneses rezonancia képalkotás; LASSO, legkisebb abszolút zsugorodás és szelekciós operátor; GBDT, gradiens korrelációs döntési fa; HISTO, hisztogram alapú mátrix; GLCM, szürke szintű együttjárási mátrix; GLRLM, szürke szintű futáshossz mátrix; GLZLM, szürke szintű zónahossz mátrix; NGLDM, szomszédos szürke szintű függőségi mátrix; AUC, a vevői működési jelleggörbe alatti terület.
Eredmények
Betegek jellemzői
Egyszerre 133 glioblasztómás (n = 76) vagy ANA-s (n = 57) beteg felelt meg a felvételi kritériumoknak. A vizsgálatba minden glioblasztómás beteget bevontak, míg 10 ANA-s beteget a kizárási kritériumoknak megfelelően kizártak. Végül 76 glioblasztómás és 46 ANA-s beteg került be ebbe a vizsgálatba. A betegek átlagéletkora 46,9 (15-67), illetve 40,0 (7-69) év volt. Valamennyi betegnél sebészi tumorrezekciót végeztek idegsebészeti osztályunkon 2015 és 2018 között. A 2. ábra két esetben mutatja a kontrasztanyaggal bővített képek axiális síkját glioblasztómás és ANA-s betegeknél.
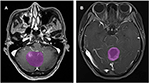
2. ábra. Példák két esetre a kontraszttal bővített MR-felvételekről glioblasztómás és ANA-s betegeknél. (A) Kontrasztbővített felvételek ANA esetén, (B) kontrasztbővített felvételek glioblastoma esetén. ANA, anaplasztikus asztrocitóma.
Glioblasztóma vs. ANA
Három modellt elemeztek ebben a tanulmányban, köztük a Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. Az ezekben a modellekben az osztályozáshoz használt textúrajellemzőket a 3. kiegészítő táblázat tartalmazza. Az egyes modellek teljesítményét az 1. táblázatban mutattuk be (beleértve az érzékenységet, a specificitást, a pontosságot és az AUC-t a képzési és a validálási csoportban). A LASSO + LDA érte el a legjobb teljesítményt a legmagasabb AUC értékekkel mind a képzési, mind a validálási csoportban. Az érzékenység, a specificitás, a pontosság és az AUC a képzési csoport esetében 0,989, 0,993, 0,996 és 0,997 volt; a validálási csoport esetében pedig 0,927, 0,989, 0,968 és 0,974 volt. Ezenkívül a Distance Correlation + LDA és a GBDT + LDA is ígéretes képességet mutatott a glioblasztóma ANA-tól való megkülönböztetésére, az AUC ≥0,95 volt mind a képzési, mind a validálási csoportok esetében.

Táblázat 1. táblázat. A glioblasztóma és az ANA közötti diszkrimináció.
A 3. ábra a LASSO + LDA modellekből származó kanonikus diszkriminációs függvények kapcsolatát mutatja a glioblasztóma és az ANA csoportokra (háromszögek és körök), valamint a csoportcentroidokra (négyzetek). Ezen az ábrán minimális átfedés volt megfigyelhető. Minőségileg a LASSO által kiválasztott adatok elemzése el tudta különíteni a glioblasztómát az ANA-tól. A 4. ábra a glioblasztómára és az ANA-ra meghatározott közvetlen LDA-függvény eloszlását mutatja az adatelemzés 100 független képzési ciklusának egyikére vonatkozóan, hogy szemléltesse a LASSO + LDA modell teljesítményét. Az LDA-függvény értékei egyértelműen eltolódtak, az ANA esetében balra, a glioblasztóma esetében pedig jobbra.
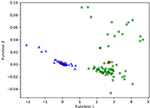
3. ábra. A LASSO + LDA modellekből származó kanonikus diszkriminatív függvények közötti kapcsolat a glioblasztóma és az ANA csoportokra (háromszögek és körök), valamint a csoportcentroidokra (négyzetek). Ezen az ábrán minimális átfedés volt megfigyelhető. Minőségileg a LASSO által kiválasztott adatok elemzése el tudta különíteni a glioblasztómát az ANA-tól. LASSO, least absolute shrinkage and selection operator; LDA, linear discriminant analysis; ANA, anaplastic astrocytoma.
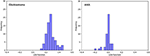
4. ábra. A glioblasztómára és az ANA-ra meghatározott közvetlen LDA-függvény eloszlása az adatelemzés 100 független képzési ciklusának egyikére a LASSO + LDA modell teljesítményének illusztrálására. Az LDA-funkció értékei egyértelműen eltolódtak, az ANA esetében balra, a glioblasztóma esetében pedig jobbra. A két csoport között minimális átfedés figyelhető meg, és erős minőségi hasonlóság figyelhető meg a ciklusok és a háromszögek ábrái között. LDA, lineáris diszkriminanciaanalízis; ANA, anaplasztikus asztrocitóma; LASSO, legkisebb abszolút zsugorodás és szelekciós operátor.
Diszkusszió
A glioblasztóma és az ANA kezelés előtti differenciáldiagnosztikája fontos, tekintettel a kezelési stratégia és a betegek prognózisának jelentős különbségére. Az MR-vizsgálat, az agydaganatok fő radiológiai preoperatív vizsgálata erősen ajánlott, mivel jó érzékenységű az elváltozás kimutatásában. A műtét előtti pontos diagnózis azonban még mindig kihívást jelent, mivel mindkét tumor hasonló jellemzőket mutat a hagyományos MR-felvételeken, amelyek az emberi szabad szemmel történő értékelésen túlmutatnak (4, 5). Ebben a tanulmányban az MR-vizsgálat maximális kihasználása érdekében a képek kvantitatív leírását végző textúrajellemzőket vontunk ki, amelyekkel három LDA-alapú modellt hoztunk létre. Az eredmények azt mutatták, hogy az MRI-alapú textúraelemzés az LDA algoritmussal kombinálva lehetővé teszi a glioblasztóma és az ANA közötti megvalósítható megkülönböztetést.
ATA egy matematikai megközelítés a voxelérték heterogenitásának jellemzésére a képeken. Vizualizálni tudná a térbeli szövettani heterogenitást, amely az emberi szemmel történő értékelés számára láthatatlan (21). Elméletileg a léziós képek jellemzői kvantitatívan elemezhetők textúrajellemzőkként, az MR-képeken megjelenő különböző felerősített mintázataik miatt (22). Továbbá, korábbi tanulmányok szerint a textúrajellemzők tükrözhetik a tumor egy sor kóros patológiai folyamatát, például ödémát, effúziót és nekrózist, ami a textúrajellemzők potenciális mechanizmusát biztosítja a glioblasztóma és az ANA megkülönböztetésében (23, 24).
A mesterséges intelligenciát széles körben feltárták a közelmúltbeli kutatásokban. A képekből kinyert textúrajellemzőkkel kombinálva a jelentések szerint segít a tumor osztályozásában, a klinikai diagnózisban és a kimenetel előrejelzésében. Egy tanulmány, amelynek célja a TA-alapú gépi tanulási algoritmusok diagnosztikai teljesítményének értékelése volt a PCNSL és a glioblasztóma megkülönböztetésében, optimális teljesítményt mutatott, az átlagos AUC 0,921 volt, míg a három olvasó AUC-ja mind <0,8 volt. Így a kutatók arra a következtetésre jutottak, hogy a TA-alapú gépi tanuláson alapuló algoritmusok diagnosztikai teljesítménye jobb volt, mint az emberi olvasóké (25). Más, hasonló célú vizsgálatok is hasonló eredményeket mutattak ki 0,85-nél magasabb AUC-értékekkel (18, 26). Sőt, a gépi tanulást az asztrocitóma osztályozásában alkalmazni kívánó kutatók szintén ígéretes diszkriminációs képességről számoltak be (27). Tanulmányunkban az osztályozási modelleket LDA algoritmusok alapján állítottuk fel. Az LDA egy olyan statisztikai osztályozó, amely a megadott paramétereket egy diszkriminanciafüggvényben kombinálja, hogy az eseteket különböző csoportokba sorolja (28). Eredményeink azt mutatták, hogy az LDA-alapú modell ígéretes teljesítményt képvisel a glioblasztóma és az ANA közötti pontos diagnózisban.
A gépi tanulási algoritmusok optimális jellemzőinek elfogadása kihívást jelentett, de a diagnosztikai teljesítményhez képest szükséges volt. A korábbi tanulmányok változatos módszerekkel végzik a jellemzők kiválasztását: Mann-Whitney U-teszt a ROC AUC-jával, Student t-teszt rekurzív feature-eliminációval, random forest és entrópia alapú diszkretizációval (18, 25, 29, 30). E tanulmányok eredményei alapján azt a következtetést vonhattuk le, hogy a megfelelő kiválasztási módszer kulcsszerepet játszik az osztályozó teljesítményében. Ami a mi vizsgálatunkat illeti, viszonylag nagyszámú paramétert vontunk ki különböző mátrixokból, ami növeli az esélyt az optimális jellemzők kiválasztásában, de növeli a kiválasztás nehézségét is. Ezért három jellemző-kiválasztási módszert (távolsági korreláció, LASSO és GBDT) értékeltünk, hogy kiválasszuk a legjobb teljesítményt nyújtó módszert. A vizsgálat eredményei azt mutatták, hogy a LASSO+LDA volt a megfelelő diszkriminatív modell a glioblasztóma ANA-tól való megkülönböztetésére, a tesztcsoportban a legmagasabb, 0,997-es AUC értékkel. A LASSO-t egy korábbi tanulmányban nemlineáris változóválasztási módszerként javasolták a neurális hálózathoz, amelynek előnye a közös hiba négyzetösszegének minimalizálása. Értelmezhető modelleket tudott létrehozni (a részhalmaz-kiválasztáshoz hasonlóan), amikor egyidejűleg a ridge-regresszió stabilitását mutatta. Korábbi tanulmányok azt mutatták, hogy ez a módszer jobb teljesítményt nyújt, mint más korszerű változóválasztási módszerek (31). Az eredményeket azonban óvatosan kell értelmeznünk, hogy a különböző gépi tanulási technikák összehasonlításából származó további információnyereség meglehetősen korlátozott, különös tekintettel arra, hogy az összes vizsgált osztályozó/jellemző-kiválasztási módszer meglehetősen összehasonlíthatónak tűnik, és az AUC varianciája részben talán a statisztikai csoportnak tulajdonítható. Ezért tanulmányunk csak hipotézisgenerálásnak tekinthető a jövőbeli, nagyobb vizsgálatokhoz.
Vizsgálatunknak volt néhány korlátja. Először is, mint retrospektív egyközpontú vizsgálat, elkerülhetetlen volt a betegek kiválasztásának torzítása. Másodszor, a bevont betegek száma viszonylag kicsi volt, és további vizsgálatokban nagyobb számú betegre volt szükség az eredmények validálásához. Harmadszor, az ANA-t ma már három kategóriába sorolják az Egészségügyi Világszervezet központi idegrendszeri daganatok 2016-os osztályozása szerint: IDH-mutáns, IDH-vadtípusú és NOS (32). A gépi tanulás képességét az ANA altípusainak megkülönböztetésében a jövőbeli vizsgálatokban fel kellett tárni. Negyedszer, a tanulmányunkban szereplő gépi tanulási modelleket valójában nem validálták más adathalmazokon. Azért nem fogadtunk el más intézmények adathalmazait, mert a textúra jellemzői eltérőek lehetnek a különböző szkennerekkel vagy protokollokkal szerzett képekből történő kivonáskor. Ez kétélű kardnak tekinthető. Egyrészt egy sor ellenőrzött változót lehetett biztosítani; másrészt az eredmények széles körű alkalmazását nem lehetett garantálni. Az elemzési protokoll és a képfeldolgozási eljárás nyílt forráskódú csomagok voltak, és nagy populáción végzett vizsgálat szükséges az eredményeink validálásához és reprodukálásához.
Következtetés
Ezzel a munkával kvantitatív paramétereket vontunk ki kontraszthangsúlyos MR-képekből, és három jellemző-kiválasztási módszert használtunk a leginkább diszkriminatív paraméterek kiválasztására. Ezután LDA algoritmust alkalmaztunk a kiválasztott paraméterek elemzésére. Tanulmányunk azt mutatja, hogy a textúrajellemzők ígéretes képességgel rendelkeznek a glioblasztóma és az ANA megkülönböztetésére. Az előzetes eredmény megerősítéséhez többközpontú, nagyobb betegszámmal végzett vizsgálatok indokoltak.
Adatok elérhetősége
Adatainkat szívesen megosztjuk minden minősített kutatóval, indokolatlan fenntartás nélkül. Kérjük, forduljanak a levelező szerzőhöz, ha bármire szükségük van.
Etikai nyilatkozat
A humán résztvevőkkel végzett vizsgálatokat a Szecsuáni Egyetem Etikai Bizottsága felülvizsgálta és jóváhagyta. A vizsgálatban való részvételhez a résztvevők törvényes gyámja/közeli hozzátartozója adta írásos beleegyezését. Az ebben a cikkben szereplő, potenciálisan azonosítható képek vagy adatok közzétételéhez a személy(ek) és a kiskorú(ak) törvényes gyámjától/közeli hozzátartozójától írásbeli, tájékoztatáson alapuló beleegyezést kaptak.
A szerzők hozzájárulása
ZT, CC, JX és XM hozzájárultak a tanulmány koncepciójához és tervezéséhez. CC és XO felvették a jogosult betegeket, és beszerezték az egyes betegek orvosi kartonjait és MRI-felvételeit. YF és ZT végezte a szövettani elemzést. JW létrehozta a modelleket és elvégezte az egyéb statisztikai elemzéseket. ZT írta a kézirat első tervezetét. CC írta a kézirat egyes részeit. Minden szerző hozzájárult a kézirat átdolgozásához, elolvasta és jóváhagyta a benyújtott változatot.
Kérdések összeférhetetlenségi nyilatkozata
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Kiegészítő anyagok
A cikkhez tartozó kiegészítő anyagok online elérhetők az alábbi címen: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abbreviations
ANA, Anaplastic astrocytoma; LDA, linear discriminant analysis; MRI, Magnetic Resonance Imaging; MR, Magnetic Resonance; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, Cerebrospinal fluid; TA, Texture analysis; ROI, Regions of interest; HISTO, Histogram-alapú mátrix; GLCM, Szürke-szintű együttjárási mátrix; GLRLM, Szürke-szintű futáshossz mátrix; GLZLM, Szürke-szintű zónahossz mátrix; NGLDM, Szomszédos szürke-szintű függőségi mátrix; AUC, A receiver operating characteristic curve alatti terület; PCNSL, Primer központi idegrendszeri limfóma; MLP, Többrétegű perceptron; IDH, Izocitrát-dehidrogenáz.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer statistics in China, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Malignus gliomák felnőttekben. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. 4. Gondolatok a glinómiáról és a kórképekről. Grimm SA, Chamberlain CM. Anaplasztikus asztrocitóma. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. The Onastroma Onastronoma. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnózis és kezelés; legújabb irodalmi áttekintés. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. A sztereotaxiás sugársebészet és az azt követő hagyományos, karmustinnal végzett sugárkezelés és a hagyományos, karmustinnal végzett sugárkezelés randomizált összehasonlítása glioblastoma multiforme-ban szenvedő betegeknél: jelentés a Radiation Therapy Oncology Group 93-05 protokolljáról. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Int. Burger PC, Heinz ER, Shibata T, Kleihues P. Topográfiai anatómia és CT összefüggések a kezeletlen glioblastoma multiforme-ban. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. A neurológiai és a neurológiai kórképek közül a legjelentősebbek közül a legjelentősebbek közül a legjelentősebbek közül a legjelentősebbek közül a legnagyobbak. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomid kemoterápia önmagában versus sugárterápia önmagában rosszindulatú asztrocitoma esetén időseknél: a NOA-08 randomizált, fázis 3 vizsgálat. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Előrelépések a primer agydaganatok értékelésében. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Az új tumoros daganatos sejtek és a tumoros daganatok vizsgálata. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme és anaplasztikus astrocytoma. Patológiai kritériumok és prognosztikai implikációk. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastoma és más rosszindulatú gliomák: klinikai áttekintés. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. MTA doktora. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. A méh leiomyosarcoma megkülönböztetése az atípusos leiomyomától: a minőségi MR-képalkotó jellemzők diagnosztikai pontossága és a textúraelemzés megvalósíthatósága. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Az orvosok és az orvostudományi szakemberek a következő kutatásokat végezték el:
. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Az MRI textúraelemzés diagnosztikus teljesítménye az agyi gliomák osztályozásában. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Az emlő kontraszthatású MR-felvételeinek texturális elemzése. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Orvosi képek textúraelemzése. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Hungarian Radiological Radiology. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Assessment of tumor heterogeneity: an emerging imaging tool for clinical practice? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Gyógyszerészi szakirodalom. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastoma és primer központi idegrendszeri limfóma: preoperatív differenciálás MRI-alapú 3D textúraelemzéssel. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Magnetic resonance image features identify glioblastoma phenotypic subtypes with distinct molecular pathway activities. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: freeware for radiomic feature calculation in multimodality imaging to accelerate advances in the characterization of tumor heterogeneity. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Cancer Res. (2018) 78:4786-9. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multiparametrikus MRI és textúraelemzés a térbeli szövettani heterogenitás és a tumor kiterjedésének megjelenítésére glioblastomában. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametrikus mágneses rezonancia képalkotás a primer agydaganatok radiomikai jellemzőkkel történő értékelésében: egy metrika az irányított sugárkezelés tervezéséhez. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Keresztmetszet | Google Scholar
. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. A képdinamikai tartomány hatása az agyi fehérállomány textúraosztályozására. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Az agyi agyvelőbántalmak és az agykárosodások vizsgálata, valamint az agykárosodások és az agykárosodások megelőzése. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. A komputertomográfiás textúrajellemzők prognosztikai értéke definitív kísérő kemoradioterápiával kezelt nem kissejtes tüdőrákban. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.00000000000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primary central nervous system lymphoma and atypical glioblastoma: Differentiation using radiomics approach. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Vö. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametrikus mágneses rezonancia képalkotás a magas fokú gliomák és az agyi áttétek megkülönböztetésére. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. 27. Gyógyszerészi szakvélemény | CrossRef Full Text | Google Scholar
. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. Egy képelemző rendszer, amely támogató vektor gépeken alapul az agydaganatos asztrocitómák automatikus fokozatdiagnózisára a klinikai rutinban. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Hírlevelek a Magyar Tudományos Akadémián. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM és LDA: összehasonlító elemzés transzradialis amputációval élő emberek EMG-adatain. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Keresztmetszet | Google Scholar
. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. A glioblastoma multiforme követéses progresszív vs. reszponzív formáinak osztályozása multiparametrikus MRI jellemzők segítségével. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. A hagyományos MRI háromdimenziós texturális jellemzői javítják a gyermekkori agydaganatok diagnosztikus osztályozását. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Az MRM MRM (2015) 28:1174-84. Sun K, Huang SH, Wong DS, Jang SS. Többrétegű perceptron neurális hálózat változóválasztási módszerének tervezése és alkalmazása LASSO-val. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
.




