KÉMIA 101 – Elektrolytok
Általános kémiai témakörök
Elektrolytok
Az ionos vegyületek vízben történő disszociációja mobil vizes ionfajok képződését eredményezi.A vízben történő oldódás és disszociáció kémiai egyenletei. Erős és gyenge elektrolitok.
Az elektrolitok (a téma zenei kísérője) olyan anyagok, amelyek vizes oldatban ionos fajokat hoznak létre. A töltéshordozók létezését az oldatban egy egyszerű kísérlettel lehet bizonyítani. A vizes közegek vezetőképességét az oldatba merített, feszültségforráshoz csatlakoztatott elektródapár segítségével lehet megfigyelni. Az oldat által vezetett áram ekkor könnyen mérhető, és egy izzó használható az oldat vezetőképességének vizuális jelzőjeként.
Ha ezt a kísérletet tiszta vízzel végezzük, az izzó egyáltalán nem világít. Maga a víz nem vezeti könnyen az elektromosságot; ez egy példa egy olyan molekuláris anyagra, amely nem elektrolit. Ez sok más molekuláris anyagra is igaz. Például az asztali cukor (szacharóz, C12H22O11) – meglehetősen jól oldódik vízben, de a cukoroldat nyilvánvalóan nem vezeti jobban az elektromosságot, mint a víz önmagában. Másrészt, ha a kísérletet egy szabadon oldódó ionos vegyülettel, például nátrium-kloriddal végezzük el, a villanykörte fényesen világít.
Az alábbi kémiai egyenletek felírásával ábrázoljuk, hogy mit gondolunk egy molekuláris és egy ionos vegyület oldódásának ezen ellentétes eseteiről:
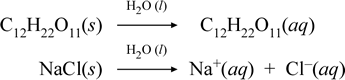
A fenti első egyenlet egy nem elektrolit, a szacharóz molekuláris vegyület oldódását ábrázolja. A második egyenlet egy ionos vegyület, a nátrium-klorid oldódását ábrázolja.A két kémiai egyenlet közötti legfontosabb különbség ebben az esetben az, hogy az utóbbiban vizes ionos fajok képződnek termékként. Az ionok egy homogén elegyben egyenként szabadon diffundálhatnak, és ha feszültséget kapcsolunk, az ionok az elektródák közötti elektromos potenciális energiakülönbségnek megfelelően mozognak, így elektromos áramot vezetnek. Figyeljük meg, hogy a víz nem szerepel ezeknek az egyenleteknek a reaktáns oldalán, hanem a nyíl fölött, ami azt jelzi, hogy a víz határozza meg azt a környezetet, amelyben az oldódási folyamat végbemegy. A víz szuperképletessége ebben a szimbolikában úgy értelmezhető, hogy az oldódási folyamat vízzel mint oldószerrel zajlik. A vizet nem írjuk reaktánsként a vizes oldat egyszerű oldódási folyamat révén történő képződésében. Számos olyan eset van, amikor egy anyag a vízzel való keveredés és a vízben való oldódás során reakcióba lép. Egy oldott anyagnak ez a reakciója vizes oldatban kémiailag különböző termékeket eredményez. Ilyen esetekben a víz kifejezetten feltüntethető a kémiai egyenletben, mint reagáló faj.
Egy erős és gyenge elektrolitok
Kiderül, hogy amikor egy oldható ionos vegyület, például a nátrium-klorid vízben oldódva szolvatált ionokból álló vizes oldatot képez, a kémiai egyenletben használt jobbra mutató nyíl annyiban indokolt, hogy (amíg az oldhatósági határértéket nem érte el) az oldószeres vízhez adott szilárd nátrium-klorid teljesen feloldódik. Más szóval, gyakorlatilag 100%-ban NaCl(s) alakul át Na+(aq)-ra és Cl-(aq)-ra. Ennek eredményeképpen a vezetőképességi kísérletünkben a nátrium-klorid oldat az ionok bősége miatt erősen vezetőképes, és az izzó fényesen világít. Ilyen esetben azt mondjuk, hogy a nátrium-klorid erős elektrolit.
Ezzel szemben tekintsük az ecetsav molekuláris anyagát, a HC2H3O2-t. Amikor az ecetsav vízben oldódik, egy nem disszociált, oldott molekuláris fajt képez, amelyet HC2H3O2(aq) jelképez, hasonlóan a fenti szacharóz esetéhez. Amikor azonban a vezetőképességi vizsgálatunkat ecetsavoldattal végezzük, azt tapasztaljuk, hogy a villanykörte világít, bár meglehetősen gyengén a nátrium-klorid oldatnál megfigyelt fényességhez képest. Ebben az esetben az ecetsavból legalább részben ionok képződhetnek a vízben. A folyamatot ábrázoló kémiai egyenletnek meg kell mutatnia az ionok keletkezését. Egy ésszerű javaslat egy ilyen egyenletre a következő lenne:
![]()
Két dolgot kell itt megjegyezni. Először is, ez az az eset, amikor a vizet mint reaktánst szerepeltetjük. A két molekuláris anyag, a víz és az ecetsav reakciója során keletkeznek a többatomos ionok, a hidronium és az acetát. Az ezt ábrázoló egyenlet egy ionegyenlet. A második jellemző, ami további tárgyalást érdemel, az a jobbra mutató nyílnak a kettős, egyágú, egyágú nyíl szimbólummal való helyettesítése, ami a kémiai egyensúlyt jelzi, és ebben az esetben a reakció egyensúlyi állapota a reakciópartnereknek kedvez, ami azt jelenti, hogy az ecetsav vizes oldatában az ecetsav nagy része ecetsavmolekulák formájában marad, és csak egy kis része adta át a H+ -ot a víznek, hogy ionokat képezzen. A keletkező ionok kis száma magyarázza, hogy az ecetsavoldat miért nem vezeti olyan jól az elektromosságot, mint a nátrium-klorid-oldat, és miért világít csak gyengén a vezetőképesség-érzékelőnk izzója. Ezért különbséget teszünk az erős elektrolitok, például a nátrium-klorid és az ecetsav között, amely egy gyenge elektrolit példája.
Amint azt az ecetsav elnevezés is sugallja, ez az anyag is sav, valamint gyenge elektrolit. Ennek megfelelően az ecetsavat a gyenge savak közé soroljuk. A sav első (és legkevésbé általános) definíciója szerint a sav olyan anyag, amely vízben hidróniumiont hoz létre, amit a fenti ionegyenletünk is mutat, szem előtt tartva, hogy egy gyenge sav viszonylag kis mennyiségű hidróniumiont hoz létre.
A kémikusok nagyon szeretik a rövidítéseket, és a hidróniumion egyik fontos rövidítése a H+(aq), és ezt gyakran használják. Ezt mutatja a fenti egyenlet rövidített változata, amely éppen alább látható. Hogy világos legyen, maga a H+ csak egy izolált proton lenne (1H esetén); ezért azt is fontos megjegyezni, hogy vizes oldatban ilyen faj nem létezik.
A nyilak továbbá egyenlőtlen hosszúságúak, hogy jelezzék a reaktánsok által előnyben részesített egyensúlyt, amelyben sokkal kevesebb ion van, mint ecetsavmolekula.
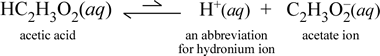
A hidrónia H+(aq)-ként való ábrázolásával az ecetsav vízben való ionegyenlete formálisan egyensúlyban van anélkül, hogy a vízmolekulát mint reaktánst tartalmazná, ami a fenti egyenletben implicit módon szerepel.
Ammónia: Egy példa a gyenge elektrolitra, amely gyenge bázis
Az ecetsav, mint az imént láttuk, egy molekuláris vegyület, amely gyenge sav és elektrolit. Az ammónia, NH3, egy másik egyszerű molekuláris vegyület, szintén kis mértékben reagál vízzel, ammónium- és hidroxidionokat képezve. Az első, legkevésbé általános bázisdefiníciónk olyan anyag, amely vízben hidroxidionokat hoz létre. Az ammónia tehát gyenge bázis, és az ecetsavhoz hasonlóan közel sem vezeti olyan jól az elektromosságot, mint a vizes só. Tehát az ammónia is gyenge elektrolit.
![]()
Kémiai egyenletünk szimbolikája ismét a gyenge elektrolit reaktáns-kedvezményes egyensúlyát jelzi.
Kiterjesztések és kapcsolatok
Az egyensúlyok kvantitatívabb megközelítése a gyenge savakat és a gyenge bázisokat használja fontos példaként.




