Tények a báriumról
A bárium a görög barys “nehéz” szóról kapta nevét, és egy viszonylag sűrű és reaktív alkáliföldfém. A természetben csak más elemekkel kombinálva fordul elő, és a báriumot tartalmazó vegyületeket sokféleképpen használják; megtalálható patkányméregben, olajfúró folyadékok súlyosító anyagában és a bárium beöntésnek nevezett röntgendiagnosztikai vizsgálat során a belek láthatóvá tételére használt fehér folyadékban.
Csak a tények
- Atomiaszám (protonok száma az atommagban): 56
- Atomi jel (az elemek időszakos rendszerében): Ba
- Atomsúly (az atom átlagos tömege): 137,327
- Sűrűség: 2,09 uncia köbinchenként (3.62 gramm köbcentiméterenként)
- Fázis szobahőmérsékleten: szilárd
- Az olvadáspont: 1,341 Fahrenheit fok (727 Celsius fok)
- Fűtőpont: 3,447 F (1,897 C)
- A természetes izotópok száma (ugyanazon elem atomjai különböző számú neutronokkal): 7
- Leggyakoribb izotóp: A bárium felfedezése
Vincenzo Casciarolo, egy 17. századi olasz alkimista figyelt fel először a báriumra szokatlan kavicsok formájában, amelyek hő hatására évekig izzottak – írja a Royal Society of Chemistry. Ezeket a kavicsokat szülővárosa után “bolognai köveknek” nevezte el, de később kiderült, hogy bárium-szulfátról (BaSO4) van szó. A 18. század végén a bárium-oxidot (BaO) és a bárium-karbonátot (BaCO3) Carl Scheele német, illetve William Withering angol kémikus fedezte fel.
A tiszta báriumfémet csak 1808-ban izolálták és azonosították a londoni Royal Institutionban. A neves kémikus és feltaláló, Sir Humphry Davy elektrolízissel választotta el a báriumot az olvadt báriumsókból, például a bárium-hidroxidból (Ba(OH)2). Az elektrolízis során elektromos áramot vezetnek át az ionos anyagon, hogy az ionokat elválasszák egymástól. Mivel a báriumsók olvadtak voltak, a báriumionok könnyen a negatív elektróddal ellátott tartály felé mozogtak, a többi negatív ion pedig könnyen az ellenkező irányba, a pozitív elektróddal ellátott tartály felé.
A bárium forrásai
A bárium a természetben csak más elemekkel együtt fordul elő, mivel nagyfokú reakcióképessége miatt. A bárium leggyakrabban szulfáttal és karbonáttal kombinálva fordul elő, de hidroxiddal, kloriddal, nitráttal, kloráttal és más negatív ionokkal is alkothat vegyületeket. A földkéreg mintegy 0,05 százaléka bárium, ami a 17. leggyakoribb elem a földkéregben – írja Robert E. Krebs “Földünk kémiai elemeinek története és használata” című könyvében: A Reference Guide” (Greenwood Publishing Group, 2006). Az Egyesült Királyság, Olaszország, a Cseh Köztársaság, az Egyesült Államok és Németország bányászati tartalékai több mint 400 millió tonna báriumot tartalmaznak John Emsley “Nature’s Building Blocks: An A-Z Guide to the Elements” (Oxford University Press, 1999).
A tiszta elemi bárium kinyeréséhez el kell választani a természetben előforduló báriumvegyületekben jelen lévő más elemektől. A báriumot bárium-kloridból elektrolízissel lehet kivonni. A báriumot úgy is ki lehet nyerni, hogy a bárium-oxidot alumínium vagy szilícium felhasználásával magas hőmérsékletű, alacsony nyomású vákuumban redukálják.
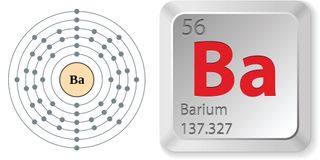
A bárium elektronkonfigurációja és elemi tulajdonságai. (A kép forrása: Greg Robson/Creative Commons, Andrei Marincas ) A bárium tulajdonságai
A tiszta bárium lágy, ezüstös fehér fém. Az alkáliföldfémek közé sorolva a periódusos rendszer 2. oszlopában található, a berilliummal, magnéziummal, kalciummal, stronciummal és rádiummal együtt. Minden atomjuk két valenciaelektront tartalmaz. A bárium az 5. periódusban, azaz az 5. sorban található, így valenciaelektronjait az ötödik héjában tartja, és nagyon könnyen elveszítheti az elektronokat, vagyis oxidálódhat. Ez magyarázza a bárium nagyfokú reakcióképességét, különösen olyan elektronegatív elemekkel, mint az oxigén.
A bárium kereskedelmi felhasználása
Az elemi báriumnak nincs sok gyakorlati felhasználása, ismét a nagyfokú reakcióképessége miatt. Az oxigénhez való erős vonzódása azonban hasznossá teszi “getterként” a vákuumcsövekben lévő levegő utolsó nyomainak eltávolítására. A tiszta bárium más fémekkel ötvözetekké kombinálható, amelyekből olyan gépelemek készülnek, mint a csapágyak vagy a belsőégésű motorok gyújtógyertyái. Mivel a bárium lazán tartja az elektronjait, ötvözetei hevítéskor könnyen bocsátanak ki elektronokat, és Krebs szerint javítják a gyújtógyertyák hatékonyságát.
A báriumot tartalmazó vegyületeket számos kereskedelmi célra használják. A bárium-szulfátot vagy baritot a litoponban (a nyomtatópapír és a festékek fényesítő pigmentje), az olajkútfúró folyadékokban, az üveggyártásban és a gumi előállításában használják. A bárium-karbonátot patkányméregként használják, a bárium-nitrát és a bárium-klorát pedig zöld színt eredményez a tűzijátékokban.
A bárium a szervezetben
Az átlagos felnőtt körülbelül 22 mg báriumot tartalmaz, mivel jelen van az olyan élelmiszerekben, mint a sárgarépa, a hagyma, a saláta, a bab és a gabonafélék. A fogak báriumszintje tulajdonképpen segíthet a tudósoknak meghatározni, hogy a csecsemők mikor térnek át a szoptatásról a szilárd ételek fogyasztására. Ezek az alacsony báriumszintek nem szolgálnak biológiai szereppel, és nem károsak.
A nagy mennyiségű oldható báriumsók azonban mérgezőek és akár halálosak is lehetnek, John Emsley szerint “A gyilkosság elemei” című könyvében: A History of Poison” című könyvében (Oxford University Press, 2005). A bárium hányást, kólikát, hasmenést, remegést és bénulást okozhat. Néhány gyilkosság történt báriumvegyületekkel, többek között 1994-ben a texasi Mansfieldben egy férfit gyilkolt meg 16 éves lánya, Marie Robards, aki bárium-acetátot lopott a középiskolai kémiai laboratóriumból. Több beteget is véletlenül megöltek báriummal, amikor a bárium beöntésnek nevezett gasztroenterológiai (GI) diagnosztikai vizsgálat során tévesen oldható bárium-karbonátot használtak oldhatatlan bárium-szulfát helyett.
A Johns Hopkins Medicine szerint az orvosok báriumos beöntést végeznek a vastagbél és a végbél rendellenességeinek láthatóvá tétele és diagnosztizálása céljából. Az eljárás során bárium-szulfátot csepegtetnek a végbélen keresztül, hogy bevonják a vastagbél belső falát. Ezután általában levegőt adnak be, hogy a bárium bevonat minden felszíni rendellenességet kitöltsön. Ezután röntgensugarakkal képet készítenek az alsó tápcsatornáról. A bárium-szulfát elnyeli a röntgensugarakat, és fehéren jelenik meg a röntgenfilmen, ellentétben a levegővel és a környező szövetekkel, amelyek feketén jelennek meg. A báriumos beöntésből származó röntgenkép elemzése lehetővé teszi az orvosok számára olyan betegségek diagnosztizálását, mint a fekélyes vastagbélgyulladás, a Crohn-betegség, a polipok, a rák és az irritábilis bél szindróma.




