塩化ナトリウム、NaCl
イオン結合の典型例で、塩化ナトリウム分子はナトリウムと塩素原子の電離とその結果生じるイオンの引力で形成されます。
ナトリウムの原子は閉殻の外に3s電子を1個持っており、その電子を取り除くのに5.14電子ボルトのエネルギーしか必要ありません。 塩素には殻を埋める電子が1つなく、その電子を獲得するときに3.62eVを放出します(電子親和力は3.62eV)。これは、ナトリウムの電子が離れているときに塩素に1つ提供するのに、わずか1.52eVのエネルギーで済むことを意味します。 このことは、両者が離れているときには、ナトリウムの電子を1個塩素に与えるのに1.52eVのエネルギーしか必要ないことを意味します。この結果、両者を近づけると、電位エネルギーはますます負になり、約0.94nm離れたところで-1.52eVに達します。 つまり、中性のナトリウム原子と塩素原子が0.94 nmより近い距離にあると、ナトリウムから塩素に電子を移動させてイオン結合を形成することがエネルギー的に有利になるのです。
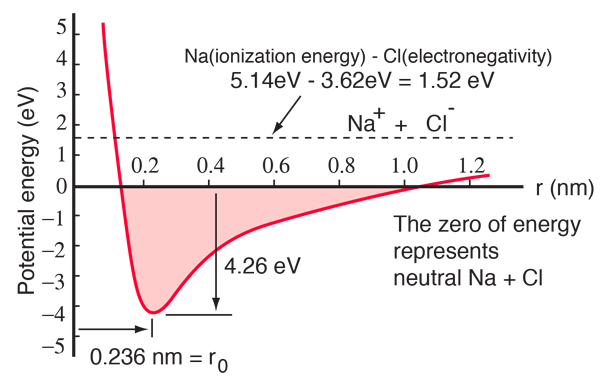
ポテンシャルエネルギー曲線は、0.236nmの距離で最小となり、その後反発力を表すポテンシャルの急上昇があることを示しています。 この反発力は、2つの原子の電子雲の間の単なる静電的な反発ではありません。 パウリの排他原理に根ざした量子力学的な性格を持っており、単に「排他原理反発」と呼ばれることも多い。 イオンが大きく離れているときは、その内殻電子の波動関数が大きく重ならず、同一の量子数を持つことができる。 しかし、近づくにつれ、波動関数の重なりが大きくなるため、一部の電子はより高いエネルギー状態に追いやられてしまう。 2つの電子が同じ状態を占めることはできないので、複合2核系に新しいエネルギー状態が形成されると、低エネルギー状態が満たされ、一部の電子が高エネルギー状態に押し出される。 これにはエネルギーが必要で、反発として経験され、イオンが互いにそれ以上近づけないようにします。
上のポテンシャル図は気体のNaClのもので、塩化ナトリウム(一般の食卓塩)が立方体の結晶を形成している通常の固体状態では環境が異なる。 イオン間隔は0.28nmで、気体状態よりやや大きくなっています。
分子構造の研究では、原子間に形成される化学結合を記述することが大きな部分を占めます。 古典的な研究は、塩化ナトリウムのイオン結合と水素分子の共有結合の両極端である。
| 化学結合 | イオン結合におけるパウリの反発 |
結合エネルギーの例




