酵素阻害
酵素は生命維持に必要なプロセスのすべてではないにしても、そのほとんどに必要とされています。 酵素は、反応が起こるのに必要な活性化エネルギーを減少させることにより、反応を触媒する。 しかし、酵素は、生成物のレベルが望ましくないレベルまで上昇しないように厳密に制御する必要がある。 これは、酵素阻害によって達成されます。
阻害の種類
可逆および非可逆阻害剤は、酵素に結合してその活性を抑制する化学物質です。 その方法の1つは、ほぼ永久的に酵素に結合することです。 このようなタイプの阻害剤を不可逆的と呼ぶ。 しかし、他の化学物質は、一過性に酵素に結合することができます。 これらは可逆的と呼ばれます。 可逆的阻害剤は、活性部位に結合するもの(競合阻害剤)と、酵素の別の部位に結合するもの(非競合阻害剤)があります。
 図1-競合阻害剤と非競合阻害剤の効果を示す図
図1-競合阻害剤と非競合阻害剤の効果を示す図競合阻害剤
競合阻害剤は活性部位で基質に競合するのでKm (Michaelis-Menten constant) を増加させる。 しかし、十分な基質濃度があれば反応は完結するため、Vmaxは変化しない。 酵素活性の基質濃度に対するグラフは、Kmの増加により右にシフトし、Lineweaver-Burkeプロットは阻害剤なしの場合と比較して急峻になります。 しかし、KMは変化しない。 これは酵素活性を基質濃度に対してプロットしたグラフの最大値が低く、Lineweaver-Burkeプロットのy切片が阻害剤なしの場合と比較して高くなることで示されます。
| Competitive | Non-Competitive | |
| どこで働くのか? | 活動的なサイト | 代替サイト |
| Kmの変化 | 増加 | 変化なし |
| Vmaxの変化 | 変化なし | 減少 |
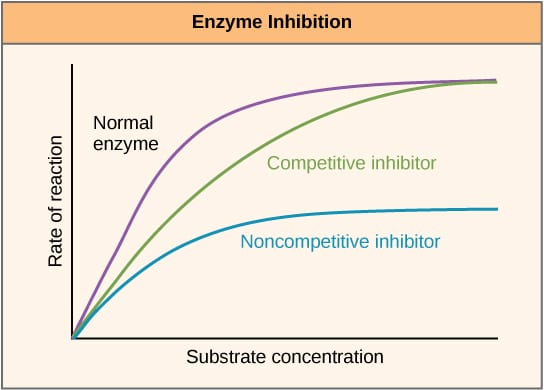 Fig 2 – – Vmaxの変化。 酵素阻害剤による反応速度への影響と基質濃度による変化を示す図。
Fig 2 – – Vmaxの変化。 酵素阻害剤による反応速度への影響と基質濃度による変化を示す図。アロステリック阻害
ミカエリス・メンテン酵素が示す双曲線とは対照的に、アロステリック酵素はシグモイド曲線を描く。 これは、ほとんどのアロステリック酵素が複数のサブユニットを持ち、基質が酵素に結合すると互いに影響しあうためである。 阻害は半飽和の基質濃度であるK0.5、Vmaxのいずれか、あるいは両方に影響を及ぼす可能性がある。 8659>
アロステリック酵素には、「T」状態と呼ばれる低親和性状態と、「R」状態と呼ばれる高親和性状態の2つの状態があります。 阻害剤は、アロステリック酵素のT状態に優先的に結合し、酵素がこの低親和性状態を維持するように働きます。
これは、ある酵素の生成物の量を制限するのに非常に便利です。なぜなら、生成物はその後、同じ種類の酵素を阻害し、生成物の量が過剰でないことを確実にすることができます。 これはフィードバック阻害と呼ばれる。 例えば、ATPはピルビン酸キナーゼをアロステリックに阻害してピルビン酸の生成が増加しないようにするので、最終的に生成されるATPは少なくなる。 さらに、ホスホフルクトキナーゼは、クレブスサイクルの中間体であるクエン酸によってアロステリックに阻害される。
 Fig 3 – アロステリック阻害と活性化のメカニズムを示す図
Fig 3 – アロステリック阻害と活性化のメカニズムを示す図 リン酸化
リン酸化は酵素が阻害される別のメカニズムを提供する。 これは通常、キナーゼ酵素の作用によって起こり、状況に応じて酵素を阻害したり活性化したりすることができる。 キナーゼ酵素はATPからリン酸基を切り離し、酵素に結合させる。 8659>
酵素原
酵素は不活性な状態で分泌されることもあり、これを酵素原という。 酵素原は、酵素が途中で活性化して機能を発揮することなく、安全に別の場所に運ぶことができる便利な仕組みである。 酵素は、タンパク質に含まれるアミノ酸が付加されることにより、不活性化されたままとなる。 したがって、酵素原を活性化するためには、別の酵素がこれらの付加的なアミノ酸を切断する必要がある。 例えば、キモトリプシノーゲンは膵臓で合成されるが、不活性化されて機能することができない。 8659>
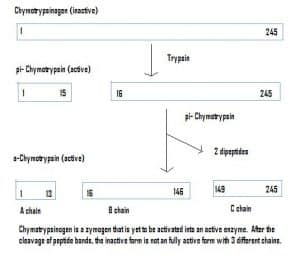 図 4 – 消化器系におけるキモトリプシノーゲンの活性化と各段階に関与する酵素を示す図。
図 4 – 消化器系におけるキモトリプシノーゲンの活性化と各段階に関与する酵素を示す図。臨床的関連性-薬物動態
酵素阻害の最も重要な臨床利用は、医薬品の使用である。 ACE阻害剤は高血圧の治療薬として一般的である。 アンジオテンシンIは、アンジオテンシン変換酵素(ACE)の作用により、アンジオテンシンIIに変換される。 しかし、アンジオテンシンIIは、血圧の上昇に関係する多くの作用を引き起こします。 そのため、ACE阻害剤はACEの作用を競合的に阻害するように設計され、その結果、アンジオテンシンIIの生成を抑え、血圧を低下させます。
また、ペニシリンはDD-トランスペプチダーゼという酵素の活性部位と不可逆的に結合します。 DD-トランスペプチダーゼは、細菌の細胞壁合成の最終段階を担っています。 8659>
最後に、シアンは非競合的阻害剤の一例である。 シアンは電子伝達連鎖の最後の酵素に結合し、この酵素が酸素から水への反応を触媒するのを阻害する。 このため、電子が電子伝達系を流れなくなり、ATPが生成されなくなり、死に至る。




