Chemistry
溶液の形成は自然過程の一例で、外部からエネルギーを必要とせずに特定の条件下で起こる過程である。 溶解を早めるために混合物をかき混ぜることがありますが、その必要はなく、十分に待てば均質な溶液が形成されます。 自発性というテーマは、化学熱力学を学ぶ上で非常に重要であり、このテキストの後の章でより詳細に扱います。 この章の議論では、溶液が自然に形成されることを保証するものではないが、好ましいとされる2つの基準について考察すれば十分であろう。
- 系の内部エネルギーの減少(前の熱化学の章で述べたように発熱的変化)
- 系の乱れの増加(後の熱力学の章で学ぶように、系のエントロピーの増加を示す)
溶解の過程で、熱が吸収または発生するので内部エネルギーの変化がしばしば起こる(常にではないが)が、このような変化が起こることもある。 8121>
溶液中の溶質と溶媒種の間の分子間引力の強さが分離した成分中に存在するものと変わらない場合、エネルギー変化を伴わずに溶液が形成される。 このような溶液を理想溶液という。 理想気体(あるいはヘリウムやアルゴンのように理想的な挙動に近い気体)の混合物は、気体を構成する物質が大きな分子間引力を受けないため、理想溶液の一例となる。
ヘリウムとアルゴンの容器を接続すると、拡散により気体は自然に混合し溶液となる(図2)。 ヘリウムとアルゴンの原子は混合前の2倍の体積を占めるので、この溶液の形成は明らかに無秩序の増加を伴っている。
理想的な溶液は、構造的に類似した液体を混ぜたときにも形成されることがある。 例えば、アルコール類のメタノール(CH3OH)とエタノール(C2H5OH)の混合物は理想溶液を形成し、炭化水素のペンタン(C5H12)とヘキサン(C6H14)の混合物もそうである。 図2の球体にメタノールとエタノール、ペンタンとヘキサンを入れると、HeとArの場合と同じように拡散して混合され、エネルギーに大きな変化のない溶液が得られる。 しかし、気体の混合液とは異なり、これらの液-液の成分には確かに分子間引力が働いている。 しかし、混合される2つの物質の分子は構造的に非常によく似ているため、似ている分子と似ていない分子の間の分子間引力は基本的に同じであり、溶解の過程でエネルギーが大きく増減することはない。 このように、溶液の自発的な形成に必要な駆動力は、拡散のみによってもたらされる。
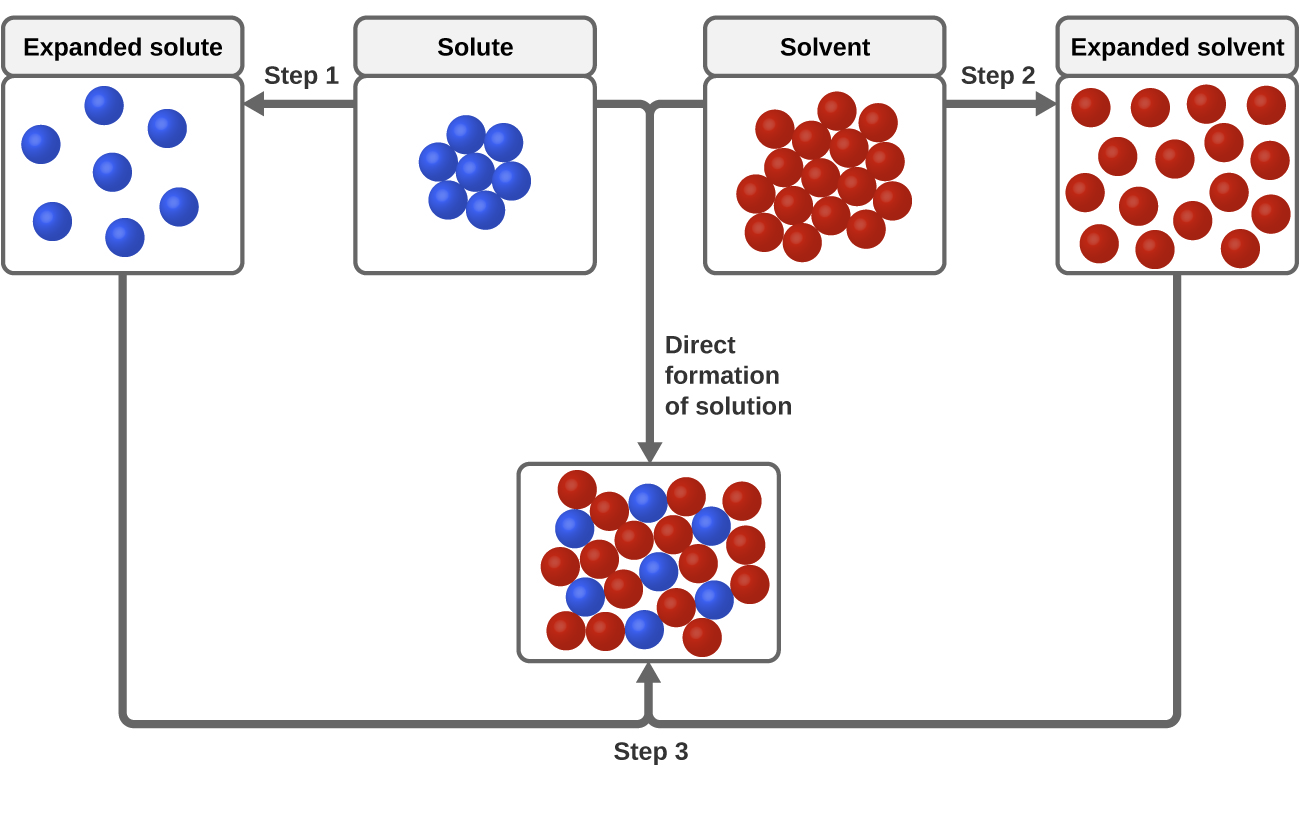
溶解プロセスには、溶質-溶質、溶質-溶媒、溶質-溶媒という3種類の分子間引力が関連している。 図3に示すように、溶液の形成は、溶質-溶質および溶媒-溶媒の引力を克服するためにエネルギーが消費され(吸熱過程)、溶質-溶媒の引力が確立されると放出される(溶媒和と呼ばれる発熱過程)段階的過程とみなすことができる。 これらの段階的なプロセスに伴うエネルギー変化の相対的な大きさによって、溶解プロセス全体がエネルギーを放出するのか吸収するのかが決定される。 場合によっては、溶質と溶媒の種を分離するために必要なエネルギーが、溶媒和によって放出されるエネルギーよりも非常に大きいため、溶液が形成されないことがあります
たとえば、食用油と水は、溶液(図 4)をもたらすためにかなりの範囲まで混合することがありません。 食用油の非極性炭化水素分子は水素結合ができず、分散力によって結合している。 油水溶液を作るには、水中の非常に強い水素結合と、比較的大きな油分子間の非常に強い分散力に打ち勝つ必要がある。 また、極性を持つ水分子と非極性を持つ油分子はあまり強い分子間引力を受けないため、溶媒和によって放出されるエネルギーは非常に小さい。

一方、エタノールと水の混合液は、任意の割合で混ざり合い、溶液を得ることができる。 この場合、両方の物質は水素結合が可能であるため、溶媒和プロセスは、溶質分子と溶媒分子の吸熱分離を補うために十分に発熱する。
このモジュールの最初に述べたように、自然溶液形成は発熱溶解プロセスによって有利になるが、保証はされていない。 多くの可溶性化合物は確かに熱を放出して溶解するが、吸熱的に溶解するものもある。 硝酸アンモニウム(NH4NO3)はその一例で、図5のような怪我の治療用の即席保冷剤を作るのに使われている。 水の入った薄肉のビニール袋の中に、固形のNH4NO3が入った大きな袋が封入されている。 この袋を破ると、NH4NO3の水溶液ができ、周囲(貼った傷の部分)の熱を吸収して、腫れを抑える冷湿布となる。 このような吸熱溶解は、溶質が溶媒和されたときに回収されるよりも、溶質種を分離するために大きなエネルギーを必要とするが、それでも溶液の形成に伴う無秩序の増加により、自発的に起こるものである。

吸熱および発熱溶解プロセスを説明するこの短いビデオをご覧ください。
Key Concepts and Summary
2 つ以上の物質が、分子レベルで均一な混合物を生成するために物理的に結合すると、溶液は形成します。 溶媒は最も濃度の高い成分であり、溶液の物理的状態を決定する。 溶質は、通常、溶媒の濃度より低い濃度で存在する他の成分である。 溶液は、溶質と溶媒の分子間引力の相対的な大きさによって、吸熱的に形成される場合と発熱的に形成される場合がある。
Chemistry End of Chapter Exercises
- How do solutions differ from compounds?
- 図1のK2Cr2O7の溶液に見られる溶液の主な特徴はどれか。
- KNO3を水に溶かすと、できた溶液は元の水よりかなり冷たくなる。
(a) KNO3の溶解は吸熱過程か発熱過程か。
(b) プロセスに関わる分子間引力についてどんな結論を導き出すことができるのか。
(c)得られた溶液は理想溶液であるか?
- 次の溶液の種類をそれぞれ例示せよ:
(a)液体中の気体
(b)a gas in a gas
(c)a solid in solid
- それぞれの溶液における分子間引力の最も重要な種類を示してください:
(a) 図 1 の溶液.a.(a.).
(b) NO(l) in CO(l)
(c) Cl2(g) in Br2(l)
(d) HCl(aq) in benzene C6H6(l)
(e) Methanol CH3OH(l) in H2O(l)
- 次の各物質は、水(極性溶媒)とヘプタンのような炭化水素(C7H16.)のどちらに多く溶けるか予測しなさい。 非極性溶媒)。
(a) 植物油(非極性)
(b) イソプロピルアルコール(極性)
(c) 臭化カリウム(イオン性)
- ある溶液ができると熱が奪われ、他の溶液ができると熱が吸収されます。 この2種類の自発的プロセスの違いを分子で説明しなさい。
- パラジウム中の水素の溶液は、パラジウム金属をH2ガスにさらすことによって形成されることがある。 パラジウム中の水素濃度は加えたH2ガスの圧力に依存するが、ヘンリーの法則で記述できるよりも複雑な様式である。 ある条件下で、0.94gの水素ガスが215gのパラジウム金属に溶けた。
(a) この溶液のモル数(溶液密度=1.8g/cm3)を求めよ。
(b) この溶液のモル数(溶液密度=1.8g/cm3)を求めよ。
(c) この溶液(溶液密度=1.8g/cm3)中の水素原子の質量%を求めよ。
。




