Frontiers in Oncology
はじめに
Glioblastoma and Anaplastic Astrocytoma (ANA) は成人の原発脳腫瘍で最も多い2つです (1). 特に高齢者では罹患率が増加するのが実情である(1-3)。 臨床の現場では、膠芽腫とANAの症状や徴候が比較的一様で非特異的であるため、手術や生検の前に患者さんを鑑別することが困難です(4, 5)。 しかし、化学療法のプロトコル、投与量、投与方法など、両者に対する管理は異なっています(6)。 例えば、ANA(WHOグレードIII)の患者さんでは、切除または生検後に放射線治療またはTMZを行うことが推奨され、新たに膠芽腫(WHOグレードIV)と診断された患者さんでは、放射線治療+同時TMZ、その後補助TMZを行います。 これまでの研究によると、膠芽腫とANAは正常脳組織への浸潤により増殖し、脳脊髄液(CSF)を介して広がり、単一の頸動脈または椎骨動脈分布を超えて広がるため、いずれも内科的治療に対する反応が悪く、成人のがん関連死の主因となる(7, 8)。 また、膠芽腫とANAは予後が異なる。 高齢者では、膠芽腫とANAの予後に大きな差はありませんが、若年者では差がある可能性があります(9)。 そのため、膠芽腫とANAの鑑別は難しいが重要である。
Magnetic Resonance Imaging(MRI)は、多面的機能と優れた軟組織コントラストにより、膠芽腫とANAの術前診断において最適な神経画像診断である。 リング状の増強と壊死の存在が膠芽腫を示唆することを示した研究もあるが,多くの場合,膠芽腫もANAもMR画像では不規則な形状(T2強調シーケンスでは高密度,T1強調シーケンスでは低密度)として現れ,Gdベースのコントラスト増強と浮腫の程度はさまざまで,そのうち違いは人間の目には通常感知できない(10-12)。
近年、テクスチャー解析(TA)はラジオミクスとも呼ばれ、様々な分野で広く応用されている。 研究者たちは、TAが、人間の評価では見えない追加の定量的情報をMR画像から取得できるため、鑑別診断を容易にする実現可能で有望な方法であることを発見しました(13-15)。 TAは、ボクセル値の周波数分布と空間構成を記述し、腫瘍組織の可能な差異を明らかにする(16)。 これまでの研究では、鑑別診断、腫瘍のサブタイプ分類、腫瘍組織の不均一性の検出におけるTAの適用可能性が検討されている(17-19)。 しかし、膠芽腫とANAの鑑別診断におけるTAの適用については、まだ報告されていない。 本研究の目的は、機械学習アルゴリズムを用いたMRIテクスチャー解析による膠芽腫とANAの鑑別能力を評価することである
材料と方法
患者選択
我々は、当施設データベースを遡り検索し、病理学的に膠芽腫またはANAと診断されたすべての患者、2015年1月から2018年12月を対象にスクリーニングを実施した。 有資格者の資格基準は以下の通りであった。 (1)膠芽腫またはANAの決定的な病理組織学的診断,(2)精巧な電子カルテ,特に病理資料,(3)外科的切除前に当施設で診断的MRスキャンを実施したこと,である。 除外基準は以下の通り。 (1)画像強度に対する瘢痕組織の干渉を考慮した頭蓋内疾患(脳外傷、頭蓋内感染、他の種類の脳腫瘍など)の既往、(2)MRIでのモーションアーチファクトの存在、(3)MRスキャン前の治療歴(手術、化学療法、放射線療法など)、(4)2016年のWHO分類体系による膠芽腫またはANAの診断基準に達していない患者、。 10年の経験を持つ上級神経病理医が、膠芽腫またはANAの基準(2016年WHO分類システム)を満たしているかどうかを判定した。 施設審査委員会は、この後ろ向き研究を承認した。 本研究に登録された参加者から、書面によるインフォームドコンセントを得た。 四川大学倫理委員会および当施設の放射線科は、本研究のための統計情報の利用を承認した
MR 画像取得
本研究に含まれるすべての患者について、造影T1強調シーケンスが利用でき、以下のパラメータで3.0T Siemens Trio Scannerで取得された。 TR/TE/TI = 1900/2.26/900 ms, Flip angle = 9°, 20 axial slices, thickness = 5 mm, axial FOV = 25.6 × 25.6 cm2 and data matrix = 256 × 256. 造影T1強調画像は、造影剤にgadopentetate dimeglumine(0.1mmol/Kg)を用い、90〜250秒の連続インターバル時間に造影MRIの多方向データを収集した。
Texture Extraction
本研究では、LifeXパッケージ(http://www.lifexsoft.org)を用いてテクスチャー特徴抽出を行っている。 腫瘍の位置と境界が明確に描出されるため,造影後T1強調(T1C)画像がさらなる解析のために選択された(20)。 関心領域(ROI)は、造影画像上の病変に沿って軸平面上でスライスごとに手動で描画し、テクスチャー特徴を得た。 患者の診療記録や病理組織診断に関知しない経験豊富な2人の脳神経外科医がROIを描き、上級放射線技師と上級脳神経外科医が編集を行った。 その際,意見の相違は上級放射線技師と上級神経外科医が協議し,対処した. MRI 画像から、minValue、meanValue、maxValue、stdValue、および 6 つのマトリクスから得られるパラメータを含む合計 40 個のテクスチャ特徴が抽出された。 ヒストグラムベース行列(HISTO)、形状、濃淡共起行列(GLCM)、濃淡走幅行列(GLRLM)、濃淡帯長行列(GLZLM)、近傍濃淡依存行列(NGLDM)
特徴量の選択
選択した6行列から得られる計40個のテクスチャ特徴量が存在した。 40個のテクスチャ特徴の説明を補足表1に示す。 また、これらのテクスチャ特徴量の統計量を補足表2に示す。 特徴量の選択は、関連性の高い特徴量を決定し、それによってオーバーフィッティングを避けるために行われた。 また、本研究で適用した機械学習アルゴリズムでは、40個のテクスチャ特徴すべてを解析に取り込むことはできない。 最適なテクスチャ特徴を選択するために、距離相関、最小絶対縮小選択演算子(LASSO)、勾配相関決定木(GBDT)の3つの独立した特徴選択法を使用した。
分類
線形判別分析(LDA)は、グループ間の分離を最大化する予測因子の線形結合を探索することにより、2つのクラスを分離するロバストな分類法である。 本研究では,LDAアルゴリズムに基づき,3つの分類モデルを構築した。 距離相関+LDA、LASSO+LDA、GBDT+LDAである。 データセットはそれぞれ、独立してLDAアルゴリズムに投入された。 各データセットは、4:1の割合でランダムに学習グループと検証グループに分けられた。 学習グループで学習されたモデルは、独立した検証グループに適用され、その性能を評価した。 LDAアルゴリズムの頑健性を評価するため,異なるランダムかつ独立した症例割付で,この手順を100サイクル分繰り返した. 病理組織学から得られた真の割付とLDAアルゴリズムによる予測値を用いて混同行列を決定した. モデルの識別能力を明らかにするため,訓練群と検証群の両方について,標準感度,特異度,受信者動作特性曲線下面積(AUC),精度を計算した. 3つのモデル(距離相関+LDA、LASSO+LDA、GBDT+LDA)の比較を行い、膠芽腫とANAに対する最適な識別モデルを決定した。 テクスチャ特徴によるMRI分類のフローチャートを図1に示す。
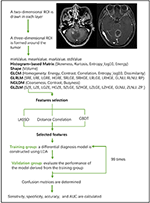
Figure 1. テクスチャー特徴によるMRI分類のフローチャート。 ANA、退形成性星細胞腫;LDA、線形判別分析;MRI、磁気共鳴画像;LASSO、最小絶対縮小選択演算子;GBDT、勾配相関決定木;HISTO、ヒストグラムベース行列;GLCM、グレーレベル共起行列;GLRLM、グレーレベルラン長行列;GLZLM、グレーレベルゾーン長行列;NGLDM、近隣グレーレベル依存行列;AUC、受信動作特性曲線下面積。
結果
患者の特徴
膠芽腫(n = 76)またはANA(n = 57)の患者133名が参加基準を満たした。 膠芽腫の患者全員が本研究に登録され,ANAの患者10人は除外基準に従って除外された。 最終的に、膠芽腫の患者76人とANAの患者46人が本研究に参加した。 患者の平均年齢はそれぞれ46.9歳(15-67歳)、40.0歳(7-69歳)であった。 すべての患者は、2015年から2018年にかけて当院脳神経外科で外科的に腫瘍切除を受けた。 図2に膠芽腫とANAの患者さんの造影画像軸面の2例を示します。
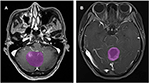
Figure 2. 膠芽腫とANA患者の造影MR画像から2例の例を示す。 (A)ANAの造影画像、(B)膠芽腫の造影画像。 ANA, Anaplastic astrocytoma.
Glioblastoma vs. ANA
本研究で解析したモデルは、Distance Correlation + LDA、LASSO + LDA、GBDT + LDAの3つであった。 これらのモデルで分類に用いたテクスチャ特徴は、補足表3に示した。 各モデルの性能は表1に示した(訓練群と検証群の感度、特異度、精度、AUCを含む)。 LASSO + LDAは、トレーニング群、検証群ともにAUCが最も高く、最高の性能を達成した。 訓練群の感度、特異度、精度、AUCはそれぞれ0.989、0.993、0.996、0.997であり、検証群では、それぞれ0.927、0.989、0.968、0.974であった。 また、Distance Correlation + LDAとGBDT + LDAもANAから膠芽腫を識別する能力を示し、トレーニンググループとバリデーショングループの両方でAUC≥0.95であった。 膠芽腫とANAの判別。
図3は、膠芽腫とANAのグループ(三角と丸)とグループのセントロイド(四角)に対するLASSO+LDAモデルからの正準判別関数の関係である。 この図では、最小限の重なりが観察された。 定性的には、LASSOで選択されたデータを分析することで、膠芽腫とANAを分離することができた。 図4は、LASSO+LDAモデルの性能を説明するために、データ解析における100の独立したトレーニングサイクルのうちの1つについて、膠芽腫とANAについて決定した直接LDA関数の分布を示している。 LDA関数値の明確なシフトがあり、ANAについては左シフト、膠芽腫については右シフトであった。
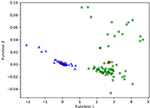
Figure 3. 膠芽腫群とANA群のLASSO+LDAモデルによる正準判別関数(三角と丸)および群のセントロイド(四角)の関係。 この図では、最小限の重なりが観察された。 定性的には、LASSOで選択されたデータを解析することで、膠芽腫とANAを分離することができた。 LASSO, 最小絶対縮小選択演算子; LDA, 線形判別分析; ANA, 退形成性星細胞腫.
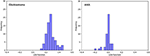
FIGURE 4. LASSO+LDAモデルの性能を説明するためのデータ分析における100の独立したトレーニングサイクルのうちの1つについて、膠芽腫とANAについて決定された直接的なLDA関数の分布である。 LDA関数の値には明確なシフトがあり、ANAは左シフト、膠芽腫は右シフトであった。 2つのグループ間で最小限の重複が見られ、サイクルとトライアングルのプロットの間に強い質的な類似性が見受けられる。 LDA, 線形判別分析; ANA, anaplastic astrocytoma; LASSO, least absolute shrinkage and selection operator.
Discussion
治療戦略や患者の予後の大きな違いを考えると、膠芽腫とANA間の前処置の鑑別診断は重要である。 脳腫瘍の術前検査の中心であるMR検査は、病変の検出感度が高く、非常に推奨されている。 しかし、従来のMR画像では、どちらの腫瘍も人間の肉眼では判断できないほど類似した特徴を示すため、手術前に正確な診断を行うことは困難である(4, 5)。 そこで本研究では、MR 画像を定量的に表現するテクスチャ特徴を抽出し、LDA に基づく3 つのモデルを構築することで、MR 検査を最大限に活用できるようにしました。 その結果、LDAアルゴリズムと組み合わせたMRIベースのテクスチャ解析により、膠芽腫とANAの鑑別が可能であることが示された。 これは、人間の目の評価では見えない空間的な組織学的不均一性を可視化することができる(21)。 理論的には、MR画像上の病変の強調パターンが異なることから、病変画像の特徴をテクスチャー特徴として定量的に解析することができる(22)。 さらに、これまでの研究で、テクスチャー特徴は、浮腫、浸出液、壊死などの腫瘍の一連の異常な病理過程を反映することが示唆されており、膠芽腫とANAの識別においてテクスチャー特徴の潜在的なメカニズムを提供している(23、24)。 画像から抽出したテクスチャ特徴と組み合わせることで、腫瘍の等級付け、臨床診断、転帰予測を支援することが報告されている。 PCNSLと膠芽腫の鑑別におけるTAベースの機械学習アルゴリズムの診断性能を評価することを目的とした研究では、平均AUCが0.921と最適な性能を示したが、3人のリーダーのAUCはすべて<0.8であった。 したがって、研究者らは、TAに基づく機械学習アルゴリズムの診断性能は、人間の読影医よりも優れていると結論づけた(25)。 同様の目的を持った他の研究でも、AUCが0.85より高く、同様の結果が示された(18、26)。 さらに、星細胞腫の等級付けに機械学習を適用することを目的とした研究者も、識別において有望な能力を報告した(27)。 本研究では、LDAアルゴリズムに基づき分類モデルを構築した。 LDAは、入力されたパラメータを判別関数に組み合わせた統計的分類法であり、症例を異なるグループに分類することができる(28)。 我々の結果は、LDAに基づくモデルが膠芽腫とANAの正確な診断において有望な性能を示すことを示した。
機械学習アルゴリズムに最適な特徴の採用は困難であるが、診断性能に関連して必要である。 これまでの研究では、様々な手法で特徴量の選択を行っている。 ROCのAUCを用いたMann-Whitney U検定、再帰的特徴除去を用いたStudentのt検定、ランダムフォレスト、エントロピーの離散化などである(18、25、29、30)。 これらの研究結果から,適切な選択方法が分類器の性能に重要な役割を果たすという結論が導き出された. 本研究では,異なる行列から比較的多くのパラメータを抽出しているため,最適な特徴量を選択できる可能性が高くなる一方で,選択の難易度も高くなる. そこで、3つの特徴選択法(距離相関法、LASSO法、GBDT法)を評価し、最も性能の良いものを選択することとした。 その結果、LASSO+LDAはテスト群のAUCが0.997と最も高く、ANAから膠芽腫を判別するのに適したモデルであることが示された。 LASSOは、ニューラルネットワークの非線形変数選択法として、共通二乗誤差の総和を最小化する利点があり、以前の研究で提案されたものである。 LASSOは、リッジ回帰の安定性と同時に、解釈可能なモデル(サブセット選択と同様)を生成することが可能である。 以前の研究では、他の最新の変数選択法よりも優れた性能を示すことが示された(31)。 しかし,調査したすべての分類器/特徴選択法がかなり比較可能であること,AUCのばらつきが統計群に部分的に起因することを考えると,異なる機械学習技術を比較することによる情報の追加利得はかなり限定的であると,結果を慎重に解釈する必要があります. したがって,本研究は,将来の大規模な研究のための仮説生成と見なすしかない。 まず,レトロスペクティブな単一施設での研究であるため,患者選択のバイアスは避けられないものであった。 第二に,対象患者数が比較的少なく,結果を検証するためにさらなる研究でより多くの患者数が必要であった。 第三に、ANAは2016年の世界保健機関(WHO)の中枢神経系腫瘍の分類に従って3つのカテゴリーに分類されるようになったことです。 IDH-mutant、IDH- wildtype、NOSです(32)。 ANAのサブタイプの判別における機械学習の能力については、今後の研究において検討する必要があった。 第四に,本研究で用いた機械学習モデルは,他のデータセットで実際に検証されていない. なぜなら、様々なスキャナーやプロトコルで撮影された画像から抽出されたテクスチャーの特徴は、異なる可能性があるからである。 これは諸刃の剣と言えるかもしれない。 一方では、制御された変数のセットを提供することができ るが、他方では、その結果が広く適用されることを保証するもので はない。 また、解析プロトコルと画像処理手順はオープンソースのパッケージであり、我々の結果を検証・再現するためには、大規模な母集団を対象とした研究が必要である。 そして,選択したパラメータをLDAアルゴリズムで解析した。 その結果、膠芽腫とANAの識別には、テクスチャーの特徴が有望であることがわかった。 この予備的な結果を確認するために、より多くの患者を対象とした多施設共同研究が必要である。
Data Availability
私たちは、資格ある研究者なら誰でも、過度の予約なしにデータを共有することを嬉しく思います。
Ethics Statement
人間を対象とした研究は、四川大学の倫理委員会によって審査され、承認されました。 本研究に参加するための書面によるインフォームド・コンセントは、参加者の法的保護者/近親者から提供された。
著者による貢献
ZT、CC、JX、およびXMは、研究の構想と設計に貢献した。 CCとXOは対象患者を登録し、各患者の医療記録とMRI画像を入手した。 YFとZTはテクスチャー解析を行った。 JWはモデルを確立し、その他の統計解析を行った。 ZTは原稿の第一稿を執筆した。 CCは原稿の一部を執筆した。
利益相反声明
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
補足資料
この論文の補足資料は、オンラインで見ることができる。 https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
略語
ANA, Anaplastic astrocytoma; LDA, linear discriminant analysis; MRI, Magnetic Resonance Imaging; MR, Magnetic Resonance; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, Cerebrospinal fluid; TA, Texture analysis; ROI, Regions of interest.参照(PDF); HISTO, ヒストグラムベース行列; GLCM, グレーレベル共起行列; GLRLM, グレーレベルラン長行列; GLZLM, グレーレベルゾーン長行列; NGLDM, 近傍グレーレベル依存行列; AUC, 受信者動作特性曲線下面積; PCNSL, 中枢神経系原発リンパ腫; MLP, 多層パーセプトロン; IDH, イソシテート脱水素酵素.AUCは、受信者動作特性曲線下面積である。
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A.世界のがん統計、2012年. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2.世界的な癌の統計、2012年。 Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer statistics in China, 2015(中国のがん統計)。 CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3.Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4.Wen、PY、Kesari、S。 Grimm SA, Chamberlain CM. 退形成性星細胞腫。 CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5.グリム SA、チェンバレン CM. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnosis and treatment; recent literature review(多形性膠芽腫の診断と治療;最近の文献レビュー). Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6.多発性膠芽腫の診断と治療:最近の文献レビュー. このガイドラインは、未分化グリオーマとグリオブラストーマの診断と治療に関するEANOガイドラインです。 Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L、Seiferheld W、Brackman D、Podgorsak EB、Werner-Wasik M、Lustig R、et al. 多形性膠芽腫患者に対する定位放射線手術後の通常放射線治療とカルムスチン併用放射線治療の無作為化比較:放射線治療腫瘍学グループ93-05プロトコルの報告書。 Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8.放射線治療と放射線防護。 このような場合、臓器移植が必要である。 J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9.膠芽腫の局所解剖とCTとの関連性。 Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. 高齢者の悪性星細胞腫に対するテモゾロミド化学療法単独と放射線療法単独:NOA-08無作為化第3相試験。 Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10.テモゾロミド化学療法単独と放射線療法単独の比較試験(NOA-08無作為化第3相試験)。 Chen W, Silverman HD. 原発性脳腫瘍の評価における進歩。 Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11.脳腫瘍の評価の進歩(2008年)。 Burger PC, Vogel FS, Green SB, Strike AT. 多形性膠芽腫と退形成性星細胞腫。 病理学的基準と予後の意味。 Cancer. (1985) 56:1106-11.
PubMed Abstract|Google Scholar
12.膠芽腫と退形成性星細胞腫の病理学的基準。 大室敦子、DeAngelis ML. 膠芽腫とその他の悪性グリオーマ:臨床的レビュー。 JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13.大室敦子, デアンゲリスML. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. 子宮平滑筋肉腫と非定型平滑筋腫の鑑別:定性的MR画像特徴の診断精度とテクスチャー解析の実行可能性。 Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14.子宮筋腫と非定型平滑筋腫の鑑別:定性的MR画像特徴の診断精度とテクスチャー分析の実現可能性(PubMed). 脳グリオーマの等級付けにおけるMRI上のテクスチャー解析の診断性能。 Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. 乳房の造影MR画像のテクスチャー解析。 Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16.乳房の造影MR画像のテクスチャ解析。 また、このような画像解析は、画像処理に必要な技術である。 Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17.医療画像のテクスチャ解析。 このような場合、「医療費助成制度」が適用される。 インサイト・イメージング。 (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18.腫瘍の不均一性の評価:臨床のための新たな画像診断ツール? Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. 膠芽腫と原発性中枢神経系リンパ腫:MRIによる3Dテクスチャー解析による術前分別。 Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. 磁気共鳴画像特徴により、異なる分子経路活性を持つ膠芽腫の表現型サブタイプが特定された。 Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20.膠芽腫は、膠原病と膠原病が混在している。 Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: a freeware for radiomic feature calculation in multimodality imaging to accelerate advances in the characterization of tumor heterogeneity.マルチモダリティイメージングにおけるラジオミックフィーチャー計算のためのフリーウェア。 Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21.腫瘍の不均一性の特性を加速させるために、マルチモダリティイメージングを行うためのフリーウェア。 Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multi-parametric MRI and texture analysis to visualize spatial histologic heterogeneity and tumor extent in glioblastoma.(膠芽腫における組織学的不均一性と腫瘍範囲を可視化するためのマルチパラメーターMRIとテクスチャー分析)。 PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22.膠芽腫の組織学的不均一性と腫瘍範囲を可視化するためのマルチパラメトリックMRIとテクスチャー解析。 Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametric magnetic resonance imaging in assessment of primary brain tumors through radiomic features: a metric for guided radiation treatment planning. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23.邦訳:「脳腫瘍の診断と治療」(日本経済新聞出版社)。 Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. 脳白質のテクスチャ分類における画像ダイナミックレンジの影響。 BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24.脳白質のテクスチャ分類における画像ダイナミックレンジの影響。 このような場合、「臓器移植が必要である」と判断される。 Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25.邦訳:「非小細胞肺がんにおけるコンピュータ断層撮影のテクスチャーフィーチャーの予後価値」(日本評論社)。 このような場合、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」、「臓器移植の必要性」を考慮する必要があります。 Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametric magnetic resonance imaging to differentiate high-grade gliomas and brain metastases. J Neuroradiol。 (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27.高悪性度グリオーマと脳転移の鑑別のためのマルチパラメトリック磁気共鳴画像。 このような状況下において,脳腫瘍性星細胞腫の自動グレード診断のためのサポートベクターマシンに基づく画像解析システム. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, and LDA: a comparative analysis on EMG data from people with trans-radial amputation. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29.邦訳:「邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳」。 Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Multi-parametric MRI featuresを用いた多形性神経膠芽腫フォローアップ進行型と反応型の分類. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30.邦訳:「多形性膠芽腫の経過観察における進行型と反応型の分類」。 Fetit AE, Novak J, Peet AC, Arvanitits NT. 従来のMRIの3次元的なテクスチャーの特徴は、小児脳腫瘍の診断分類を改善する。 NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31.小児脳腫瘍の診断のための3次元テクスチャーフィーチャー。 Sun K, Huang SH, Wong DS, Jang SS. また、このような研究成果を基に、「多層パーセプトロンのためのLASSOによる変数選択法の設計と応用」を提案した。 IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32.邦訳:「邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳」。 Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. 2016 World Health Organization classification of tumors of the central nervous system: a summary(中枢神経系の腫瘍に関する2016年世界保健機関分類:要約). Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
.




