Pocket K No. 17: Engenharia Genética e Cultivos GM
Nos últimos 50 anos, o campo da engenharia genética desenvolveu-se rapidamente devido à maior compreensão do ácido desoxirribonucleico (DNA) como o código químico de dupla hélice a partir do qual os genes são feitos. O termo engenharia genética é usado para descrever o processo pelo qual a composição genética de um organismo pode ser alterada usando a “tecnologia do DNA recombinante”. Isto envolve o uso de ferramentas de laboratório para inserir, alterar ou cortar pedaços de DNA que contenham um ou mais genes de interesse.
Desenvolver variedades vegetais expressando boas características agronômicas é o objetivo final dos cultivadores de plantas. Com o cultivo convencional de plantas, no entanto, há pouca ou nenhuma garantia de obter qualquer combinação genética particular a partir dos milhões de cruzamentos gerados. Genes indesejáveis podem ser transferidos juntamente com genes desejáveis; ou, enquanto um gene desejável é ganho, outro é perdido porque os genes de ambos os progenitores são misturados e reordenados mais ou menos aleatoriamente na descendência. Esses problemas limitam as melhorias que os criadores de plantas podem alcançar.
Em contraste, a engenharia genética permite a transferência direta de um ou apenas alguns genes de interesse, entre organismos próximos ou distantes para obter o traço agronômico desejado (Figura 1). Nem todas as técnicas de engenharia genética envolvem a inserção de DNA de outros organismos. As plantas também podem ser modificadas pela remoção ou desligamento de seus próprios genes particulares.
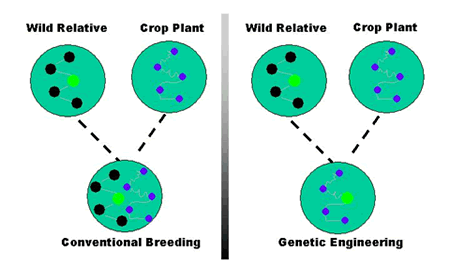
Figure 1. Comparando a reprodução convencional com a engenharia genética.
Source: Biotecnologia Agrícola (Muito mais do que apenas culturas GM). http://www.isaaa.org/resources/publications/agricultural_biotechnology/download/
| Criação convencional | Engenharia genética |
|
|
Fonte: Biotecnologia Agrícola (Muito mais do que apenas colheitas GM). http://www.isaaa.org/resources/publications/agricultural_biotechnology/download/.
Genes são moléculas de DNA que codificam traços ou características distintas. Por exemplo, uma sequência genética particular é responsável pela cor de uma flor ou pela capacidade de uma planta em combater uma doença ou prosperar em ambiente extremo.
O próprio engenheiro genético da natureza
A “partilha” de DNA entre formas vivas está bem documentada como um fenómeno natural. Durante milhares de anos, os genes mudaram de um organismo para outro. Por exemplo, Agrobacterium tumefaciens, uma bactéria do solo conhecida como “o próprio engenheiro genético da natureza”, tem a capacidade natural de engendrar geneticamente as plantas. Provoca a doença dos felos da coroa numa vasta gama de plantas de folhas largas, tais como maçã, pêra, pêssego, cereja, amêndoa, framboesa e rosas. A doença ganha seu nome devido às grandes tumefacções tumorais (galinhas) que ocorrem tipicamente na coroa da planta, logo acima do nível do solo. Basicamente, a bactéria transfere parte de seu DNA para a planta, e este DNA se integra ao genoma da planta, causando a produção de tumores e alterações associadas no metabolismo da planta.
Aplicação da engenharia genética na produção de culturas
Técnicas de engenharia genética são usadas somente quando todas as outras técnicas tiverem sido esgotadas, i.e. quando a característica a ser introduzida não está presente no germoplasma do cultivo; a característica é muito difícil de melhorar pelos métodos de cultivo convencionais; e quando levará muito tempo para introduzir e/ou melhorar tal característica no cultivo pelos métodos de cultivo convencionais (ver Figura 2). As culturas desenvolvidas através da engenharia genética são comumente conhecidas como culturas transgênicas ou culturas geneticamente modificadas (GM).
O melhoramento vegetal moderno é um processo multidisciplinar e coordenado onde um grande número de ferramentas e elementos de técnicas de melhoramento convencional, bioinformática, genética molecular, biologia molecular e engenharia genética são utilizados e integrados.
Figure 2: Modern Plant Breeding
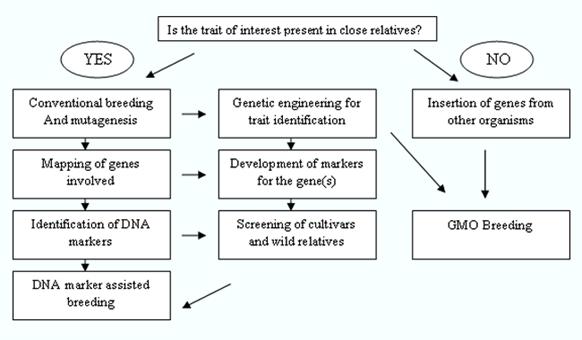
Source: DANIDA, 2002.
Desenvolvimento de cultivos transgênicos
Embora existam muitas técnicas diversas e complexas envolvidas na engenharia genética, seus princípios básicos são razoavelmente simples. Há cinco etapas principais no desenvolvimento de uma cultura geneticamente modificada. Mas para cada passo, é muito importante conhecer os mecanismos bioquímicos e fisiológicos de ação, regulação da expressão gênica e segurança do gene e do produto genético a ser utilizado. Mesmo antes de uma cultura geneticamente modificada estar disponível para uso comercial, ela tem que passar por rigorosos procedimentos de segurança e avaliação de risco.
O primeiro passo é a extração do DNA do organismo conhecido por ter o traço de interesse. O segundo passo é a clonagem do gene, que isolará o gene de interesse de todo o DNA extraído, seguido da produção em massa do gene clonado em uma célula hospedeira. Uma vez clonado, o gene de interesse é concebido e embalado para que possa ser controlado e devidamente expresso uma vez dentro da planta hospedeira. O gene modificado será então produzido em massa em uma célula hospedeira, a fim de fazer milhares de cópias. Quando o pacote genético estiver pronto, ele pode então ser introduzido nas células da planta que está sendo modificada através de um processo chamado transformação. Os métodos mais comuns usados para introduzir o pacote genético nas células da planta incluem a transformação biolística (usando uma arma genética) ou a transformação mediada por Agrobacterium. Uma vez que o gene inserido é estável, herdado e expresso nas gerações seguintes, então a planta é considerada transgênica. O cruzamento cruzado é a etapa final do processo de engenharia genética, onde o cultivo transgênico é cruzado com uma variedade que possui características agronômicas importantes, e selecionado para obter plantas de alta qualidade que expressam o gene inserido de forma desejada.
O tempo de desenvolvimento da planta transgênica depende do gene, da espécie do cultivo, dos recursos disponíveis e da aprovação regulatória. Pode levar de 6 a 15 anos até que um novo híbrido transgênico esteja pronto para lançamento comercial.
Culturas comercialmente disponíveis melhoradas por engenharia genética
Culturas transgênicas têm sido plantadas em diferentes países por vinte anos, a partir de 1996. Cerca de 191,7 milhões de hectares foram plantados em 2018 para cultivos transgênicos de alto valor de mercado, tais como soja, milho, algodão e canola resistentes a herbicidas; milho, algodão, batata e arroz resistentes a insetos; e abóbora e mamão. Com a engenharia genética, mais de uma característica pode ser incorporada ou empilhada em uma planta. Cultivos transgênicos com traços combinados também estão disponíveis comercialmente. Estes incluem milho, soja e algodão resistentes a herbicidas e insetos.
Novas e futuras iniciativas em engenharia genética de cultivos
Até agora, os cultivos GM comerciais têm proporcionado benefícios na produção de cultivos, mas também há uma série de produtos em pipeline que farão contribuições mais diretas para a qualidade dos alimentos, benefícios ambientais, produção farmacêutica e cultivos não-alimentares. Exemplos desses produtos incluem: arroz com tripla característica biotecnológica com melhor rendimento em meio a tensões abióticas, castanheira biotecnológica com resistência ao flagelo do castanheiro, cítricos biotecnológicos resistentes ao verde, batata enriquecida com beta-caroteno, sorgo biofortificado, banana bacteriana (Xanthomonas) resistente à murcha, banana Bunchytop resistente ao vírus, trigo resistente a insetos, entre outros.
- Biotecnologia agrícola na Europa. 2003. Desenvolvimentos Futuros na Biotecnologia das Culturas. Documento Temático 6. http://cms.daegu.ac.kr/sgpark/life&chemistry/future.pdf.
- DANIDA. 2002. Assessment of Potentials and Constraints for Development and Use of Plant Biotechnology in Relation to Plant Breeding and Crop Production in Developing Countries (Avaliação de Potenciais e Restrições ao Desenvolvimento e Uso da Biotecnologia Vegetal em Relação à Reprodução Vegetal e à Produção Agrícola nos Países em Desenvolvimento). Ministério das Relações Exteriores, Dinamarca.
- Desmond, S. e T. Nicholl. 1994. An Introduction to Genetic Engineering (Introdução à Engenharia Genética). Imprensa da Universidade de Cambridge.
- Giddings, G., G. Allison, D. Brooks, e A. Carter. 2000. Transgenic Plant as Factories for Biopharmaceuticals. Biotecnologia da Natureza 18: 1151-1155.
- Goto, F., R. Yoshihara, N. Shigemoto, S. Toki, e F. Takaiwa. 1999. Iron Fortification of Rice Seed by the Soybean Ferritin Gene (Fortificação de Ferro de Sementes de Arroz pelo Ferritin Gene da Soja). Nature Biotechnology 17: 282-286.
- ISAAA. 2018. Situação Global das Culturas Biotecnológicas Comercializadas/GM: 2018. ISAAA Brief No. 54. ISAAA: Ithaca, NY.
- Lopez-Bucio, J., O. M. de la Vega, A. Guevara-Garcia, e L. Herera-Estrella. 2000. Melhora na absorção de fósforo em plantas de tabaco transgênico que produzem em excesso citrato. Nature Biotechnology 18: 450-453.
- Robinson, C. 2001. Tecnologia de Modificação Genética e Alimentos: Saúde e Segurança do Consumidor. Série de Monografias Concisas ILSI Europe. http://www.ilsi.org/Europe/Publications/C2002Gen_Mod.pdf.
- Universidade do Nebraska – Lincoln. 2015. Visão Geral da Engenharia Genética de Culturas. http://passel.unl.edu/pages/informationmodule.php?
idinformationmodule=957879329&topicorder=8&maxto=9. - Ye, X., S. Al-Babili, A. Kloti, J. Zhang, P. Lucca, e I. Potrykus. 2000. Engineering the Provitamin A (b-carotene) Biosynthetic Pathway into (Carotinoid-Free) Rice Endosperm. Ciência 287(5451): 303-305..
*Atualizado em março de 2020




