Bolsillo K nº 17: Ingeniería genética y cultivos transgénicos
Durante los últimos 50 años, el campo de la ingeniería genética se ha desarrollado rápidamente debido al mayor conocimiento del ácido desoxirribonucleico (ADN) como código químico de doble hélice del que están hechos los genes. El término ingeniería genética se utiliza para describir el proceso mediante el cual se puede alterar la composición genética de un organismo utilizando la «tecnología del ADN recombinante». Esto implica el uso de herramientas de laboratorio para insertar, alterar o cortar trozos de ADN que contienen uno o más genes de interés.
Desarrollar variedades de plantas que expresen buenas características agronómicas es el objetivo final de los fitomejoradores. Sin embargo, con el fitomejoramiento convencional, hay poca o ninguna garantía de que se obtenga una combinación genética concreta de los millones de cruces generados. Pueden transferirse genes indeseables junto con genes deseables; o, mientras se gana un gen deseable, se pierde otro porque los genes de ambos progenitores se mezclan y se reordenan de forma más o menos aleatoria en la descendencia. Estos problemas limitan las mejoras que pueden lograr los fitomejoradores.
En cambio, la ingeniería genética permite la transferencia directa de uno o sólo unos pocos genes de interés, entre organismos estrechamente o distantemente relacionados para obtener el rasgo agronómico deseado (Figura 1). No todas las técnicas de ingeniería genética implican la inserción de ADN de otros organismos. Las plantas también pueden modificarse eliminando o desactivando sus propios genes.
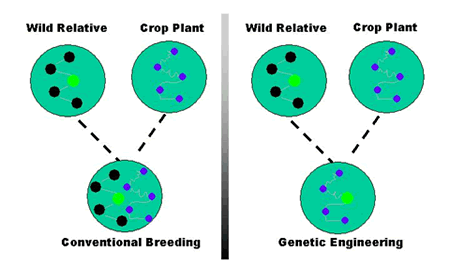
Figura 1. Comparación entre la cría convencional y la ingeniería genética.
Fuente: Biotecnología agrícola (Mucho más que cultivos transgénicos). http://www.isaaa.org/resources/publications/agricultural_biotechnology/download/
| Crianza convencional | Ingeniería genética |
|
|
Fuente: Biotecnología agrícola (Mucho más que cultivos transgénicos). http://www.isaaa.org/resources/publications/agricultural_biotechnology/download/.
Los genes son moléculas de ADN que codifican rasgos o características distintas. Por ejemplo, una secuencia genética concreta es responsable del color de una flor o de la capacidad de una planta para combatir una enfermedad o prosperar en un entorno extremo.
El propio ingeniero genético de la naturaleza
El «intercambio» de ADN entre formas vivas está bien documentado como fenómeno natural. Durante miles de años, los genes han pasado de un organismo a otro. Por ejemplo, Agrobacterium tumefaciens, una bacteria del suelo conocida como «el propio ingeniero genético de la naturaleza», tiene la capacidad natural de modificar genéticamente las plantas. Provoca la enfermedad de la agalla de la corona en una amplia gama de plantas de hoja ancha, como el manzano, el peral, el melocotón, el cerezo, el almendro, el frambueso y el rosal. La enfermedad recibe su nombre por las grandes hinchazones de tipo tumoral (agallas) que suelen aparecer en la corona de la planta, justo por encima del nivel del suelo. Básicamente, la bacteria transfiere parte de su ADN a la planta, y este ADN se integra en el genoma de la planta, provocando la producción de tumores y los cambios asociados en el metabolismo de la planta.
Aplicación de la ingeniería genética en la producción de cultivos
Las técnicas de ingeniería genética se utilizan sólo cuando se han agotado todas las demás técnicas, es decir.es decir, cuando el rasgo que se va a introducir no está presente en el germoplasma del cultivo; el rasgo es muy difícil de mejorar por métodos de mejora convencionales; y cuando llevará mucho tiempo introducir y/o mejorar dicho rasgo en el cultivo por métodos de mejora convencionales (véase la figura 2). Los cultivos desarrollados mediante ingeniería genética se conocen comúnmente como cultivos transgénicos o cultivos modificados genéticamente (MG).
El fitomejoramiento moderno es un proceso multidisciplinar y coordinado en el que se utilizan e integran un gran número de herramientas y elementos de las técnicas de fitomejoramiento convencionales, la bioinformática, la genética molecular, la biología molecular y la ingeniería genética.
Figura 2: Fitomejoramiento moderno
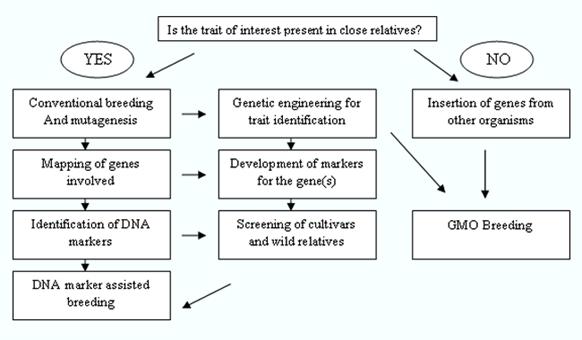
Fuente: DANIDA, 2002.
Desarrollo de cultivos transgénicos
Aunque hay muchas técnicas diversas y complejas involucradas en la ingeniería genética, sus principios básicos son razonablemente simples. Hay cinco pasos principales en el desarrollo de un cultivo transgénico. Pero para cada paso es muy importante conocer los mecanismos bioquímicos y fisiológicos de acción, la regulación de la expresión génica y la seguridad del gen y del producto génico que se va a utilizar. Incluso antes de que un cultivo modificado genéticamente esté disponible para su uso comercial, tiene que pasar por rigurosos procedimientos de evaluación de la seguridad y el riesgo.
El primer paso es la extracción de ADN del organismo que se sabe que tiene el rasgo de interés. El segundo paso es la clonación del gen, que aislará el gen de interés de todo el ADN extraído, seguido de la producción en masa del gen clonado en una célula huésped. Una vez clonado, el gen de interés se diseña y empaqueta para que pueda ser controlado y expresado adecuadamente una vez dentro de la planta huésped. A continuación, el gen modificado se producirá en masa en una célula huésped para hacer miles de copias. Cuando el paquete de genes está listo, puede introducirse en las células de la planta que se está modificando mediante un proceso denominado transformación. Los métodos más comunes utilizados para introducir el paquete genético en las células de la planta incluyen la transformación biolística (utilizando una pistola de genes) o la transformación mediada por Agrobacterium. Una vez que el gen insertado es estable, se hereda y se expresa en las siguientes generaciones, la planta se considera transgénica. El retrocruzamiento es el último paso del proceso de ingeniería genética, en el que el cultivo transgénico se cruza con una variedad que posea rasgos agronómicos importantes, y se selecciona para obtener plantas de alta calidad que expresen el gen insertado de la forma deseada.
El tiempo que se tarda en desarrollar una planta transgénica depende del gen, de la especie de cultivo, de los recursos disponibles y de la aprobación normativa. Pueden pasar entre 6 y 15 años antes de que un nuevo híbrido transgénico esté listo para su liberación comercial.
Cultivos comercialmente disponibles mejorados mediante ingeniería genética
Los cultivos transgénicos se han plantado en diferentes países durante veinte años, a partir de 1996. En 2018 se plantaron unos 191,7 millones de hectáreas de cultivos transgénicos con alto valor de mercado, como la soja, el maíz, el algodón y la canola tolerantes a los herbicidas; el maíz, el algodón, la patata y el arroz resistentes a los insectos; y la calabaza y la papaya resistentes a los virus. Con la ingeniería genética, se puede incorporar o apilar más de un rasgo en una planta. Los cultivos transgénicos con rasgos combinados también están disponibles comercialmente. Entre ellos se encuentran el maíz, la soja y el algodón tolerantes a los herbicidas y resistentes a los insectos.
Iniciativas nuevas y futuras en materia de ingeniería genética de cultivos
Hasta la fecha, los cultivos transgénicos comerciales han aportado beneficios en la producción de cultivos, pero también hay una serie de productos en proyecto que contribuirán de forma más directa a la calidad de los alimentos, los beneficios medioambientales, la producción farmacéutica y los cultivos no alimentarios. Algunos ejemplos de estos productos son: el arroz biotecnológico de triple rasgo con mayor rendimiento frente a las tensiones abióticas, el castaño biotecnológico resistente al chancro del castaño, los cítricos biotecnológicos resistentes al enverdecimiento, la patata enriquecida con betacaroteno, el sorgo biofortificado, el plátano resistente a la marchitez bacteriana (Xanthomonas), el plátano resistente al virus Bunchytop y el trigo resistente a los insectos, entre otros.
- Biotecnología agrícola en Europa. 2003. Desarrollos futuros en biotecnología de cultivos. Issue Paper 6. http://cms.daegu.ac.kr/sgpark/life&chemistry/future.pdf.
- DANIDA. 2002. Assessment of Potentials and Constraints for Development and Use of Plant Biotechnology in Relation to Plant Breeding and Crop Production in Developing Countries. Ministerio de Asuntos Exteriores, Dinamarca.
- Desmond, S. y T. Nicholl. 1994. An Introduction to Genetic Engineering. Cambridge University Press.
- Giddings, G., G. Allison, D. Brooks y A. Carter. 2000. Transgenic Plant as Factories for Biopharmaceuticals. Nature Biotechnology 18: 1151-1155.
- Goto, F., R. Yoshihara, N. Shigemoto, S. Toki, y F. Takaiwa. 1999. Iron Fortification of Rice Seed by the Soybean Ferritin Gene. Nature Biotechnology 17: 282-286.
- ISAAA. 2018. Estado mundial de los cultivos biotecnológicos/transgénicos comercializados: 2018. ISAAA Brief No. 54. ISAAA: Ithaca, NY.
- López-Bucio, J., O. M. de la Vega, A. Guevara-Garcia, y L. Herera-Estrella. 2000. Enhanced Phosphorous Uptake in Transgenic Tobacco Plants that Overproduce Citrate. Nature Biotechnology 18: 450-453.
- Robinson, C. 2001. Genetic Modification Technology and Food: Consumer Health and Safety. ILSI Europe Concise Monograph Series. http://www.ilsi.org/Europe/Publications/C2002Gen_Mod.pdf.
- Universidad de Nebraska – Lincoln. 2015. Visión general de la ingeniería genética de cultivos. http://passel.unl.edu/pages/informationmodule.php?
idinformationmodule=957879329&topicorder=8&maxto=9. - Ye, X., S. Al-Babili, A. Kloti, J. Zhang, P. Lucca, and I. Potrykus. 2000. Engineering the Provitamin A (b-carotene) Biosynthetic Pathway into (Carotinoid-Free) Rice Endosperm. Science 287(5451): 303-305..
*Actualizado en marzo de 2020




